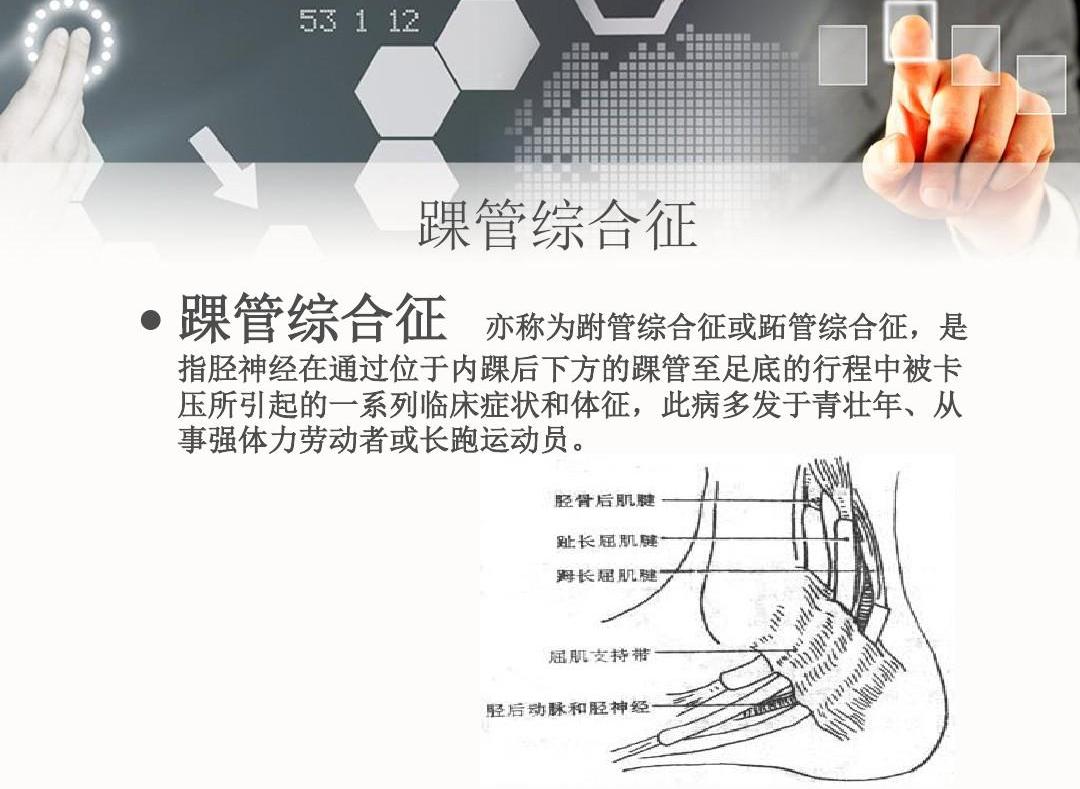
病因介紹
主要指發生于胃和十二指腸的慢性潰瘍,是一多發病、常見病。潰瘍的形成有各種因素,其中酸性胃液對粘膜的消化作用是潰瘍形成的基本因素,因此得名。酸性胃液接觸的任何部位,如食管下段、胃腸吻合術後吻合口、空腸以及具有異位胃粘膜的Meckel憩室。絕大多數的潰瘍發生于十二指腸和胃,故又稱胃、十二指腸潰瘍。本病确診後一般采取綜合性治療措施,包括内科基本治療、藥物治療、并發症的治療和外科治療。治療消化性潰瘍的目的在于:①緩解臨床症狀;②促進潰瘍愈合;③防止潰瘍複發;④減少并發症。但現有的各種療法尚不能改變消化性潰瘍的自然病程和徹底根治潰瘍。
潰瘍一般是由外傷、微生物感染、腫瘤、循環障礙和神經功能障礙、免疫功能異常或先天皮膚缺損等引起的局限性皮膚組織缺損。外傷性潰瘍往往是由物理和化學因素直接作用于組織引起。微生物感染性疾病多由細菌、真菌、螺旋體、病毒等引起組織破壞。結節或腫瘤破潰。免疫異常引起的血管炎性潰瘍系因動脈或小動脈炎使組織發生壞死而形成。循環或神經功能障礙屬營養障礙引起組織壞死,如靜脈曲張、麻風潰瘍等。
(一)細菌性疾病
貌疖腫、癰、蜂窩織炎、汗腺炎、皮膚結核、賺瘡、皮膚炭疽、鼻疽、皮膚白喉、壞死性痤瘡、下瘠型膿皮病、麻風、熱帶潰瘍、分枝杆菌性潰瘍、遊泳池肉芽腫、口腔結核性潰瘍。
(二)真菌性疾病
抱子絲菌病、皮膚隐球菌病、組織胞漿菌病、球抱子菌病、曲菌病、足菌腫、放線菌病、奴卡菌病、黃癬、膿癬、皮膚毛黴菌病。
(三)病毒性疾病
手足口病、口蹄疫。
(四)寄生蟲病
皮膚阿米巴病、皮膚蠅蛆病。
(五)性傳播疾病
生殖器瘡疹、梅毒、軟下瘡膚股溝肉芽腫、性病性淋巴肉芽腫病。
(六)變應性皮膚病
固定性藥疹。
(七)血管炎及血管性疾病
結節性多動脈炎、變應性血管炎、血栓閉塞性脈管炎、丘疹壞死性結核疹、硬紅斑、壞疽性
膿皮病、緻死性中線肉芽腫、wegener肉芽腫、閉塞性動脈硬化症、淤滞性皮炎、雷諾症。
(八)物理性疾病
射線皮炎、凍瘡、褥瘡。
(九)職業性皮膚病
鉻、鎳、鈉、鋅、钴、鹽酸、硫酸、氫氟酸、氫氧化鈉、碳酸鈉均可引起皮膚潰瘍。
(十)自身免疫疾病
白塞病。
(十一)腫瘤
濕疹樣癌萬房外濕疹樣癌、基底細胞癌。鱗癌、惡性黑色素瘤、皮脂腺癌、章樣肉芽腫、惡性組織細胞增生症上kaposi肉瘤、毛鞘癌、纖維肉瘤、增殖性紅斑、疣狀癌、多發性漿細胞瘤。
(十二)其他
連續性肢端皮炎、結節性脂肪壞死、脂肪肉芽腫、足穿通性潰瘍、阿弗他口腔炎、壞疽性龜頭炎、急性女陰潰瘍。
症狀體征
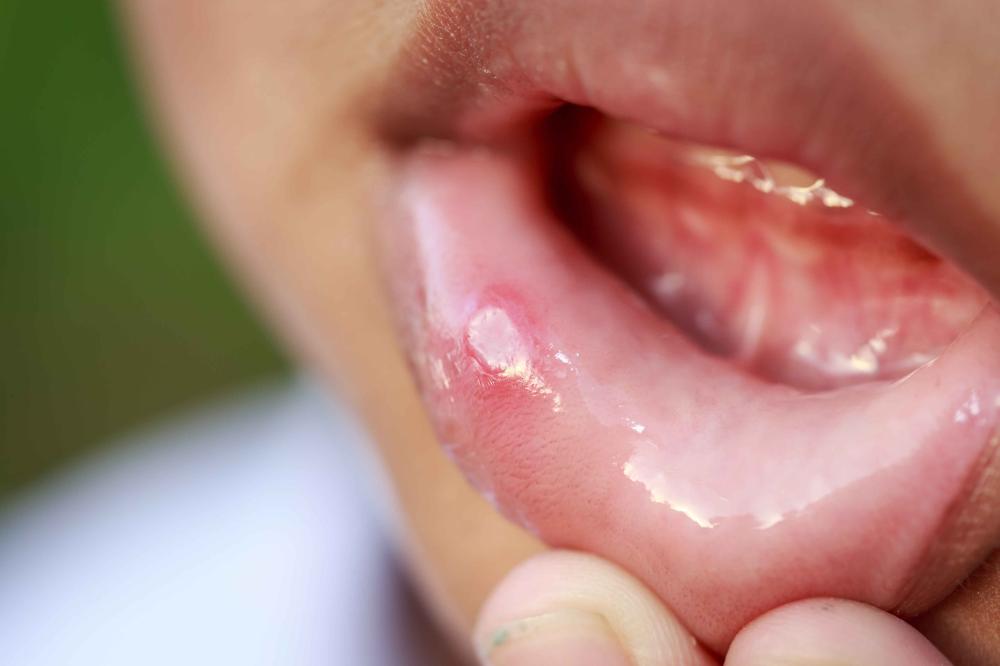
潰瘍系上皮組織潰破脫落,而形成的表面呈凹陷性損害,并有覆痂。本病的臨床表現不一,部分患者可無症狀,或以出血、穿孔等并發症作為首發症狀。多數消化性潰瘍有以下一些特點:
①慢性過程呈反複發作,病史可達幾年甚或十幾年。
②發作呈周期性,與緩解期互相交替。期長短不一,短的隻是幾周或幾月,長的可幾年。發作有季節性,多在秋冬和冬春之交發作,可因精神情緒不良或服NSAID誘發。
③發作時上腹痛呈節律性。
一、症狀上腹痛為主要症狀,可為鈍痛、灼痛、脹痛或劇痛,但也可僅有饑餓樣不适感。典型者有輕度或中度劍突下持續疼痛,可被抗酸藥或進食所緩解。大約有2/3的疼痛呈節律性:早餐後1-3小時開始出現上腹痛,如不服藥或進食則要堅持至午餐才緩解。食後2-4小時又痛,也需進食來緩解,約半數有午夜痛,患者常痛醒。GU也可發生規律性疼痛,但餐後出現較早,約在餐後1/2-1小時出現,至下次餐前自行消失。午夜痛也可發生,但不如DU多見。部分病例無上述典型疼痛,而僅表現為無規律性的較含糊的上腹隐痛不适,伴脹滿、厭食、嗳氣、反酸等症狀,多見于GU病例。随着病情發展,可因發病症的出現而發生症狀改變。潰瘍痛是一種内髒痛,具有上腹痛而部位不很确定的特點。如果疼痛加劇而部位固定,放射至背部,不能被抗酸藥緩解,常提示有後壁慢性穿孔;突然發生上腹劇烈迅速延及全腹時應考慮有急性穿孔;有突發眩暈者說明可能并發出血。
二、體征潰瘍活動時劍突下可有一固定而局限的壓痛點,緩解時無明顯體征。
病理生理
一、幽門螺旋杆菌感染大量研究充分證明,幽門螺旋杆菌(Hp)感染是消化性潰瘍的主要原因。
(一)消化性潰瘍患者中Hp感染率高如能排除檢測前患者服用過抗生素、铋劑或非甾體抗炎藥(NSAID)等因素,DU患者的Hp感染率為90%-100%,GU為80%-90%。樣Hp感染者中發生消化性潰瘍的危險性亦顯着增加。前瞻性研究顯示,Hp感染者中大約15%-20%的人可發生消化性潰瘍。
(二)根據Hp可促進潰瘍愈合和顯着降低潰瘍複發率根除Hp而無抑制胃酸分泌作用的治療分按可有效愈合潰瘍;用常規抑制為散分泌藥物治療療效不理想的所謂難治性潰瘍,在有效根除Hp治療後,得到痊愈;應用高療效Hp方案治療1周,随後不再給予抗潰瘍治療,療程結束後4周複查,潰瘍的愈合率高于或等于應用常規抑制胃酸分泌藥連續治療4-6周的愈合率。這些結果從不同的角度證明了根除Hp可促進潰瘍愈合。飛揚頻繁複發曾是消化性潰瘍自然史的主要特點之一。用常規抑制胃酸分泌藥物治療後愈合的潰瘍,停藥後飛揚的年複發率為50%-70%。根除Hp可使DU、GU的年複發率降至5%以下,從而使絕大多數潰瘍患者得到徹底治愈。此外,根除Hp還可顯着降低消化性潰瘍出血等并發症的發生率。
(三)Hp感染改變了粘膜侵襲因素與防禦因素之間的平衡Hp憑借其毒力因子的作用,在胃型粘膜(胃和有胃化生的十二指腸)定植,誘發局部炎症和免疫反應,損害局部粘膜德國防禦/修複機制;另一方面,Hp感染可增加促胃液素和胃酸的分泌,增強了侵襲因素。這兩分析的協同作用造成了胃十二指腸粘膜損害和潰瘍形成。Hp的毒力因子包括使Hp能夠在胃型粘膜定植的因子和誘發組織損害的因子兩大類,一些因子兼有兩方面的作用。Hp的定植部位在胃粘膜上皮表面和粘液底層;一般胃窦Hp數量較多,胃體和胃底較少,亦可栖居于十二指腸胃化生粘膜。Hp在胃内定植,處要抵抗胃酸殺滅作用外,還要依靠其運動穿過粘液層。Hp菌體呈螺旋形,一端有鞭毛,為其運用提供了動力。Hp産生的尿酶水解尿素成為氨和二氧化碳,氨在Hp周圍形成"氨雲",中和周圍胃酸,從而保護Hp。Hp特異的粘附以胃上皮,使其毒素容易作用于上皮細胞。Hp的粘附特異性反映了它存在粘附因子,而胃上皮細胞存在粘附因子的特異性受體。Hp的毒素、有毒性作用的酶和Hp誘導的粘膜炎症反應均能造成胃十二指腸粘膜屏障損害。空泡毒素蛋白和細胞毒素相關基因蛋白是Hp毒力的主要标志。VacA蛋白可使培養的細胞産生空泡;CagA蛋白的确切功能尚不清楚。尿素酶分解尿素産生的氨除了對Hp本身有保護作用外,還能直接和間接造成粘膜屏障損害。Hp的粘液酶降解粘液,促進H+反彌散;Hp脂多糖具有内毒素的特性,可刺激細胞因子的釋放,幹擾胃上皮細胞與層粘素的互相作用而使粘膜喪失完整性。Hp的酯酶和磷酯酶A降解脂質和磷脂,破壞細胞膜完整性。Hp産生的一些低分子蛋白可趨化和激活炎症細胞,後者釋放多種細胞因子和産生有毒性的氧自由基。Hp的某些組分抗原與胃粘膜某些細胞成分相似,即所謂抗原模拟,Hp激發機體産生的抗體,可與宿主胃粘膜細胞成分起交叉反應,導緻胃粘膜細胞損傷。Hp感染可引起高促胃液素血證,其機制包括:
①Hp感染引起的炎症和組織損傷使胃窦粘膜中D細胞數量減少,影響生長抑制素産生,使後者對G細胞釋放促胃液素的抑制作用減弱。
②Hp尿素酶水解尿素産生的氨使局部粘膜pH升高,破壞了胃酸對G細胞釋放促胃液素的反饋抑制。Hp感染對胃酸影響的報道不盡一緻。多數報告顯示,Hp陽性DU患者的基礎、進餐和促胃液素等刺激的胃酸分泌高于Hp陽性健康志願者的基礎胃酸和刺激的胃酸分泌亦高于Hp陰性的對照者,但升高的幅度小于Hp陽性的DU患者。Hp感染所緻的高促胃液素血症是引起高胃酸分泌的原因之一。Hp感染引起消化性潰瘍的機制有多種假說。"漏屋頂"假說把胃粘膜屏障比喻為屋頂,保護其下方粘膜組織免受胃酸的損傷。當粘膜首先Hp損害時(形成"漏屋頂")就會造成泥漿水(H+反彌散),導緻粘膜損傷和潰瘍形成。這一假說強調了Hp感染所緻的防禦因素減弱,可解釋Hp相關GU的發生。六因素假說将胃酸-胃蛋白酶、胃化生、十二指腸炎、Hp感染、高促胃液素血症和談散氫鹽分泌六個因素綜合起來,解釋Hp在DU發病中作用。胃窦部Hp感染、遺傳因素等引起高胃酸分泌,高酸直接損傷上皮或引起繼發炎症使十二指腸粘膜發生胃化生,為Hp在十二指腸粘膜定植創造條件。十二指腸Hp感染加重了局部炎症(十二指腸),炎症又促進胃化生。這一惡性循環使十二指腸粘膜持續處于炎症和損傷狀态,局部碳酸氫鹽分泌減少,削弱了十二指腸粘膜的防禦因素。而Hp感染所緻的高促胃液素血症刺激胃酸分泌,增強了侵襲因素。侵襲因素的增強和防禦因素的削弱導緻潰瘍形成。
二、胃酸和胃蛋白酶消化性潰瘍的最終形成是由于胃酸-胃蛋白酶自身消化所緻,這一概念在"Hp時代"仍未改變。胃蛋白酶是主細胞分泌的胃蛋白酶原經鹽酸激活轉變而來,它能降解蛋白質分子,所以對粘膜有侵襲作用。胃蛋白酶的生物活性取決于胃液pH,這是因為不但胃蛋白酶原激活需要鹽酸,而且胃蛋白酶活性是pH依賴的,當胃液pH升高到4以上時,胃蛋白酶就失去了活性。由于胃蛋白酶的活性受到胃酸制約,因而在探讨消化性潰瘍發病機制和治療措施時,主要考慮胃酸的作用。在無酸的情況下罕有潰瘍的發生,抑制胃酸分泌和藥物促進潰瘍愈合,因此胃酸的存在是潰瘍發生的決定因素。DU無患者的平均基礎酸排量(BAO)和五肽促胃液素等刺激後的最大酸排量(MAO)常大于正常人,MAO低于10mmol/h者甚少發生DU。但DU患者的MAO變異範圍很大,與正常人之間有明顯重疊,僅20%-50%着高于正常,GU患者的基礎和刺激後的胃酸排出量多屬正常甚至低于正常,僅發生于幽門前區或伴有DU者的GU患者的胃酸排出量可高于正常,與DU相比GU中為散分泌量改變似乎不很顯着。DU患者胃酸分泌增多,主要與下列因素有關:
①壁細胞總數增多:胃酸分泌量與壁細胞總數相平行,DU患者的平均PCM可達正常人之1.5-2倍。壁細胞數量增加可能受遺傳因素影響和(或)是高促胃液素血症(如在促胃液素瘤、Hp感染)長期刺激的結果。
②壁細胞對刺激物敏感性增強:DU患者對事物或五肽促胃液素刺激後的胃酸分泌反應多大于正常人,這可能是患者壁細胞上促胃液素受體的親和力增加或體内對促胃液素刺激胃酸分泌有抑制作用的物質如生長抑素減少(如Hp感染)所緻。
③胃酸分泌的正常反饋抑制機制發生缺陷:正常人胃窦部G細胞分泌促胃液素的功能受到胃液pH負反饋調節,當胃窦部pH降至2.5以下時,G細胞分泌促胃液素的功能就受到抑制。此外,當食糜進入十二指腸後,胃酸和食糜刺激十二指腸和小腸粘膜釋放胰泌素、膽囊收縮素、腸抑胃肽(GIP)和血管活性腸肽(VIP)等,這些激素具有抑制胃酸分泌的作用。所以正常情況下,胃酸分泌具有自身調節作用。部分DU患者的這一反饋機織存在缺陷,遺傳、Hp感染等是可能的影響因素。
④迷走神經張力增高:迷走神經釋放乙酰膽堿,後者兼有直接刺激壁細胞分泌鹽酸和刺激G細胞分泌促胃液素的作用。
三、非甾體抗炎藥一些藥物對胃十二指腸粘膜具有損傷作用,其中以NSAID最為顯着。長期攝入NSAID可誘發消化性潰瘍、妨礙潰瘍愈合、增加潰瘍複發率和出血、穿孔等并發症的發生率。由于攝入NSAID後接觸胃粘膜的時間較十二指腸長,因而與GU的關系更為密切。長期服用NSAID者中,約50%的患者内鏡觀察有胃十二指腸粘膜糜爛和(或)出血點,5%-30%的患者有消化性潰瘍。潰瘍發生的危險性除與服用NSAID的種類、劑量大小和療程長短有關外,還可能與患者年齡、Hp感染、吸煙、同時服用糖皮質激素等因素有關。NSAID損傷胃十二指腸粘膜的原因除藥物直接作用外,主要通過抑制前列腺素合成,削弱後者對胃十二指腸粘膜的保護作用。在美國約5%的DU和25%的GU與長期服用NSAID有關。
四、遺傳因素随着Hp在消化性潰瘍發病中重要作用得到認識,遺傳因素的重要性受到了挑戰。
首先,消化性潰瘍的家庭群集現象究竟是遺産因素還是環境因素起主要作用?流行病學調查顯示,Hp感染有"家庭聚集"現象,家庭成員中分離到Hp多為同一菌株,提示Hp在家庭内人與人之間傳播。因此消化性潰瘍的家庭群集現象可能主要是由于Hp感染在家庭内傳播所緻。
第二,曾被認為與遺傳有關的消化性潰瘍亞臨床标志,即高胃蛋白酶原血症I和家族性高促胃液素血症,在根除Hp後大多可恢複正常,提示Hp感染而不是遺傳起來主要作用。
第三,O型血者發生DU的危險性較其他血型者高,曾被視為間接"遺傳标志"。近年發現Hp在胃型上皮特異定植是由于其粘附引資與胃審批細胞受體特異結合,Lewisb血型抗原就是一種特異受體,O型血者細胞表面表達更多粘附受體,提示O型血者易得DU還是與Hp感染有關。但遺傳因素的作用不能就此否定。孿生兒觀察表明,單卵雙胎同胞發生潰瘍的一緻性都高于雙卵雙胎;在一些罕見的遺傳綜合征中,如多内分泌腺瘤病I型、系統性肥大細胞增多症等,消化性潰瘍為其臨床表現的一部分。
五、胃十二指腸運動異常部分DU患者的胃排空比正常人快,特别是液體排空。胃液體排空加快使十二指腸球部的酸負荷量增大,粘膜易遭損傷。少部分此異常者有家族史,部分GU患者存在胃運動障礙,表現為胃排空延緩和十二指腸-胃反流。含者使胃窦部張力增高,刺激胃窦粘膜中的G細胞分泌促胃液素,進而增加胃酸分泌;後者主要由于胃窦-十二指腸運動協定和幽門括約肌功能障礙所緻。反流液中的膽汁、胰液和溶血磷脂酰膽堿(卵磷脂)對胃粘膜有損傷作用。胃運動障礙本身不大可能是GU的原發病因,但可加重Hp感染或攝入NSAID對胃粘膜的損傷。
六、應激和心理因素急性應激可引起應激性潰瘍已是共識。但在慢性潰瘍患者,情緒應激和心理矛盾的緻病作用一直有争論。臨床觀察表明長期精神緊張、要率或情緒波動的人易患消化性潰瘍;DU愈合後在遭受精神應激時,潰瘍容易複發或發生并發症;戰争期間,本病發生率升高。上述事實提示:心理因素對消化性潰瘍特别是DU的發生有明顯影響。但心理分析未能發現消化性潰瘍患者有何特殊個性。應激和心理因素可通過迷走神經機制影響胃十二指腸分泌、運動和粘膜血流的調控。
七、其他危險因素
(一)吸煙 吸煙者消化性潰瘍的發生率比不吸煙者高,吸煙影響潰瘍愈合、促進潰瘍複發和增加潰瘍并發症發生率。吸煙影響潰瘍形成和愈合的确切機制不明,可能與吸煙增加胃酸、胃蛋白酶分泌,抑制胰腺分泌碳酸氫鹽,降低幽門括約肌張力和影響胃粘膜前列新素合成等因素有關。
(二)飲食飲食與消化性潰瘍的關系不十分明确。酒、濃茶、咖啡和某些飲料能刺激胃酸分泌,攝入後易産生消化不良症狀,但尚無充分證據表明長期飲用會增加虧将發生的危險性。據稱,必需脂肪酸攝入增多與消化性潰瘍發病率下降相關,前者通過增加胃十二指腸粘膜中前列腺素前提成分而促進前列腺素合成。高鹽飲食被認為可增加GU發生的危險性,這與高濃度鹽損傷胃粘膜有關。
(三)病毒感染很少部分潰瘍患者的胃窦潰瘍或幽門前區潰瘍邊緣可檢出I型單純疱疹病毒,而離潰瘍較遠的組織中則陰性,這些患者無全身性HSV-1感染或免疫缺陷的證據,提示HSV-1局部感染可能與"消化性潰瘍"的形成有關。在腎移植或免疫缺陷的患者中,亦可能有巨細胞病毒感染。
病理:DU多發生在球部,前壁比較常見;GU多在胃角和胃窦小彎組織學上,GU大多發生在幽門腺區(胃窦)與泌酸腺區(胃體)交界處的幽門腺區一側。幽門腺區粘膜可随年齡增大而擴大(假幽門腺化生和(或)腸化生),使其與泌酸區粘膜之交界線上移,故老年患者GU的部位多較高。潰瘍一般為單個,也可多個,呈圓形或橢圓形。DU直徑多小于10mm,GU要比DU稍大。亦可見到直徑大于2cm的巨大潰瘍。潰瘍邊緣光整、底部潔淨,由肉芽組織構成,上邊複蓋有灰色或灰黃色纖維滲出物。活動性潰瘍周圍粘膜常有炎症水腫。潰瘍淺者累及粘膜肌層,深者達肌層甚至漿膜層,潰破血管時引起出血,穿破漿膜層時引起穿孔。潰瘍愈合時周圍粘膜炎症、水腫消退,邊緣上皮細胞增生複蓋潰瘍面(粘膜重建),其下的肉芽組織纖維化轉變為瘢痕,瘢痕收縮使周圍粘膜皺襞向其集中。
診斷檢查
一、幽門螺旋杆菌檢測Hp感染的診斷已成為消化性潰瘍的常規檢測項目,其方法可分為侵入性和非侵入性兩大類,前者需作胃鏡檢查和胃粘膜活檢,可同時确定存在的胃十二指腸疾病,後者僅提供有無Hp感染的信息。目前常用的侵入性試驗包括快速尿素酶試驗、組織學檢查、粘膜塗片染色鏡檢、微需氧培養和聚合酶鍊反應(PCS)等;非侵入性試驗主要有13C-或14C-尿素呼氣試驗(13C-UBT或14C-UBT)和血清學試驗等。快速尿素酶試驗是侵入性試驗中診斷Hp感染的首選方法,操作簡便、費用低。組合學檢查可直接觀察Hp,與常規HE染色相比,Warthin-Starry等特殊染色能提高檢出率。胃粘膜塗片後染色鏡檢方法較簡便,但細菌數量少時,易漏診。Hp培養和PCR檢側技術要求和費用相對較高,主要用于科研。非侵入性試驗中13C-UBT或14C-UBT檢測Hp感染的敏感性和特異性高,可作為根除治療後複查的首選方法。定性檢測抗Hp抗體IgG的血清學試驗不宜作為治療後複查的首選方法。定性檢測抗Hp抗體IgG的血清學試驗不宜作為治療後Hp是否根除的證實試驗。
二、胃液分析GU患者的胃酸分泌正常或低于正常,部分DU患者則增多,但與正常人均有很大重疊,故胃液分析對消化性潰瘍診斷和鑒别診斷價值不大。目前主要用于促胃液素瘤的輔助診斷,如果BAO>15mmol/h、MAO>60mmol,BAO/MAO比值>60%,提示有促胃液素瘤之可能。
三、血清促胃液素測定消化性潰瘍時血清促胃液素較正常人稍高,但診斷意義不大,故不應列為常規。但如懷疑有促胃液素瘤,應作此項測定。血清促胃液素值一般與胃酸分泌呈反比,胃酸低,促胃液素高;胃酸高,促胃液素低;促胃液素瘤時則兩者同時升高。
診斷:病史分析很重要,典型的周期性和節律性上腹部疼痛是診斷消化性潰瘍的主要線索。但必須指出,有潰瘍症狀者不一定患有消化性潰瘍,而相當部分消化性潰瘍患者的上腹疼痛常不典型,更有一部分患者可無疼痛症狀。因而單純依靠病史難以作出可靠診斷。确診需要依靠X線鋇餐檢查和(或)内鏡檢查,後者尤有診斷價值。
一、X線鋇餐檢查氣鋇雙重對比造影能更好地顯示粘膜象。潰瘍的X線征象有直接和間接兩種:龛影是直接征象,對潰瘍診斷有确診價值。良性潰瘍凸出于胃、十二指腸鋇劑輪廓之外,在其周圍常見一光滑環提,其外圍輻射狀粘膜皺襞。間接征象包括局部壓痛、胃大彎側痙攣性切痕、十二指腸球部激惹和球部畸形等,間接征象僅提示有潰瘍。
二、胃鏡檢查和粘膜活檢胃鏡檢查不僅可對胃十二指腸粘膜直接觀察、攝影,還可在直視下取活檢作病理和Hp檢測。它對消化性潰瘍的診斷和良、惡性潰瘍鑒别診斷的準備性高于X線鋇餐檢查。在潰瘍太小或太表淺,鋇餐檢查難以發現;鋇餐檢查發現的十二指腸球部畸形可有多種解釋難以确診;活動性上消化道出血是鋇餐檢查的禁忌證,内鏡檢查可确定其來源和性質。鋇餐檢查或内鏡下看似良性的GU中,大約5%實際是惡性的,反之少部分看似惡性的潰瘍,事實證明是良性的,不作活檢難以鑒别。此外,内鏡檢查還可發現伴随潰瘍的胃炎和十二指腸炎。内鏡下消化性潰瘍多呈
圓形或橢圓形,偶也呈線狀,邊緣光整,底部充滿灰黃色或白色滲出物,周圍粘膜可有充血、水腫,有時見皺襞向潰瘍集中。内鏡下潰瘍可分為活動期(A)、愈合期(H)和瘢痕期(S)三個病期,其中每一病期又可分為1和2兩個階段。
治療方案
治療目的在于消除病因、解除症狀、愈合潰瘍、防止複發和避免并發症。消化性潰瘍在不同的患者病因不盡相同,發病機制亦各異,所以對每一例應分析其可能涉及的緻病因素及病理生理,給以适當的處理。
一、一般治療生活要有規律,工作宜勞逸結合,要避免過度勞累和精神緊張,如有焦慮不安,應予開導,必要時可給鎮靜藥。原則上需強調進餐要定時,避免辛辣、過鹹食物及濃茶、咖啡等飲料。牛乳和豆醬雖能一時稀釋胃酸,但其所含鈣和蛋白質能刺激胃酸分泌,故不宜過飲。如有煙酒嗜好而确認與潰瘍的發病有關者,應即戒除。服用NSAID者,應盡可能停服;即使患者未服此類藥物,亦應告誡其今後慎用。
二、藥物治療70年代以前本病的治療主要依賴抗酸藥和抗膽堿藥,H2RA的問世在治療上引起第一次變革;根除Hp是治療上的重大裡程碑。
(一)根除Hp治療根除Hp可使大多數Hp相關性潰瘍患者完全達到治療目的。國際已對Hp相關性潰瘍的處理達成共識,即不論潰瘍初發或複發,不論活動或靜止,不論有無并發症史,均應抗Hp治療。
1、根除Hp的治療方案由于大多數抗菌藥物在腸内低pH環境中活性降低和不能穿透粘液層到達細菌,因此Hp感染不易根除。迄今為止,尚無單一藥物能有效根除Hp,因而發展了将抑制胃酸分泌藥、抗菌藥物或起協同作用的膠體铋劑聯合應用的治療方案。根除Hp的治療方案大體上可分為質子泵抑制劑(PPI)為基礎和膠體铋劑為基礎的兩大類。一種PPI或一種膠體铋劑加上克拉黴素(甲紅黴素)、阿莫西林(或四環素)、甲硝唑(或替硝唑)3種抗菌藥物中的2種,組成三聯療法。Hp菌株對甲硝唑耐藥率正在迅速上升。呋喃唑酮抗Hp作用強,Hp不易産生耐藥性,可用呋喃唑酮替代甲硝唑,劑量為200mg/d,分兩次服。可用H2RA替代PPI,以降低費用,但療效亦有所降低。初次治療失敗者,可用PPI、膠體铋劑合并兩種抗菌藥物的四聯療法。
2、根除Hp治療結束後是否需繼續抗潰瘍治療對此尚未統一。治療方案療效高而潰瘍面積又不很大時,單一抗Hp治療1-2周就可使活動性潰瘍有效愈合。若根除Hp方案療效稍低、潰瘍面積較大、抗Hp治療結束時患者症狀未緩解或近期有出血等并發症史,應考慮在抗Hp治療結束後繼續用抑制胃酸分泌藥治療2-4周。
3、抗Hp治療後複查抗Hp治療後,确定Hp是否根除的試驗應在治療完成後不少于4周時進行。接受高效抗Hp方案(根除率≥90%)治療的大多數DU患者無必要進行證實Hp根除的試驗。難治性潰瘍或有并發症史的DU,應确立Hp是否根除。因GU有潛在惡變的危險,原則上應在治療後适當時間作胃鏡和Hp複查。對經過适當治療仍有頑固消化不良症狀的患者,亦應确立Hp是否根除。
(二)抑制胃酸分泌藥治療潰瘍的愈合特别是DU的愈合與抗酸治療強度和時間成正比。堿性抗酸藥(如氫氧化鋁、氫氧化鎂及其複方制劑)中和胃酸(兼有一定細胞保護作用),對緩解樣疼痛症狀有較好效果,但要促使潰瘍愈合則需大劑量多次服用才能奏效。多次服藥的不便和長期服用大劑量抗酸藥物可能帶來的不良反應限制了其應用。目前已很少單一應用抗酸藥來治療潰瘍,可作為加強止痛的輔助治療。抗膽堿藥哌侖西平(哌吡氮平)和促胃液素受體拮抗劑丙谷胺治療潰瘍療效不夠理想,已很少用于治療潰瘍。目前臨床上常用的抑制胃酸分泌藥有H2RA和PPI兩大類。PPI作用于壁細胞胃酸分泌終末步驟中的關鍵酶--H+-K+-ATP酶生成時,壁細胞才恢複泌酸功能。因此PPI抑制胃酸分泌作用比H2RA更強,且作用持久。目前至少有四種PPI已用于臨床,分别為奧美拉唑、蘭索拉唑、潘托拉唑和拉貝拉唑。一般劑量為奧美拉唑20mg、蘭索拉唑30mg、潘托拉唑40mg和拉貝拉唑10mg,每天一次口服;根除Hp治療時劑量需加倍。
(三)保護胃粘膜治療胃粘膜保護劑主要有三種,即硫糖鋁、枸橼酸铋鉀和前列腺素類藥物米索前列醇。這些藥物治療4-8周的潰瘍愈合率與H2RA相似。硫糖鋁抗潰瘍作用的機制主要與其粘附覆蓋作潰瘍面上阻止為散和胃蛋白酶繼續侵襲潰瘍面、促進内源性前列腺素合成和刺激表皮生長因子分泌等有關。硫糖鋁不良反應少,便秘是其主要不良反應。枸橼酸铋鉀除了具有硫糖鋁類似的作用機制外,尚有較強的抗Hp作用。短期服用枸橼酸铋鉀除了舌苔發黑外,很少出現不良反應;為避免铋在體内過量積蓄,不宜連續長期服用。米索前列醇具有抑制胃酸分泌、增加胃十二指腸粘膜粘液/碳酸氫鹽分泌和增加粘膜血流的作用。腹瀉是其主要不良反應,因可引起子宮收縮,孕婦忌服。
(四)NSAID潰瘍的治療和預防對NSAID相關性潰瘍,應盡可能暫停或減少NSAID劑量,并檢測Hp感染和進行根除治療。用PPI治療,GU或DU的愈合可能不受或較少受到繼續服用NSAID的影響,故當未能中止NSAID治療時,應選用PPI進行治療。既往有消化性潰瘍病史或有嚴重疾病、高齡等因素對潰瘍及其并發不能承受者,可預防性地同時服用抗消化性潰瘍病藥。米索前列醇可預防NSAID誘發的GU和DU。PPI亦能起到預防作用,但标準劑量的H2RA則否。
(五)潰瘍複發的預防Hp感染、服用NSAID、吸煙等是影響潰瘍複發的可除去的危險因素,應盡量除去;潰瘍複發頻繁時,不要忘記排除促胃液素瘤。由于極大多數消化性潰瘍是Hp相關性潰瘍,而Hp真正根除後,潰瘍的複發率可顯著降低,因此确定有無Hp感染非常重要。需要指出的是,Hp感染"根除"後,或初次檢測陰性者,仍有陽性可能。出現這種情況大多是由于檢測當時未排除幹擾因素,Hp暫時受到抑制而未能檢出,或由于檢測方面不夠可靠。Hp真正根除後成人的再感染率很低,約為每年1%-3%。在根除Hp治療中,由于耐藥菌株藥物不良反應、患者依從性差等因素,在一個甚至兩個療程治療後仍有部分患者的Hp未能得到根除。有并發症的潰瘍和難治性潰瘍容易複發,高齡或伴有嚴重疾病者對潰瘍及其并發症不能承受,這些都是預防複發的重點對象。維持治療曾是預防潰瘍複發的主要措施,但與根除Hp治療相比,維持治療需沉澱服藥,停藥後潰瘍仍會複發,療效也不如前者,因此需對維持治療的地位作重新評價。由于存在Hp陰性潰瘍、根除Hp後仍有少部分潰瘍會複發、目前根除治療方案的療效尚難達到百分之百以及Hp根除後仍有一定再感染率等原因,維持治療仍有一定地位。實際上,根除Hp治療與維持治療互補,才能最有效地減少潰瘍複發和并發症。維持治療一般多用H2RA體拮抗劑,常用方案為标準劑量半量睡前頓服,也可用奧美拉唑10mg/d或20mg每周2-3次口服進行維持治療。維持治療的時間長短,需根據具體情況決定,短者3-6個月,長者1-2年,甚至更長時間。
三、消化性潰瘍治療的策略對胃鏡或X線檢查診斷明确的DU或GU,首先要區分Hp陽性還是陰性。如果陽性,則應首先抗Hp治療,必要時在抗Hp治療結束後再給予2-4周抑制胃酸分泌治療。對Hp陰性的潰瘍包括NSAID相關性潰瘍,可按過去的常規治療,即服任何一種H2RA或PPI,DU療程為4-6周,GU為6-8周。也可用粘膜保護劑替代抑制胃酸分泌藥治療GU。至于是否進行維持治療,應根據潰瘍複發聘禮、患者年齡、服用NSAID、吸煙、合并其他嚴重疾病、潰瘍并發症史等危險因素的有無,綜合考慮後作出決定。至于外科治療,由于内科治療的進展,僅限少數有并發症者。手術适應證為:①大量出血經内科緊急處理無效時;②急性穿孔;③瘢痕性幽門梗阻;④内科治療無效的頑固性潰瘍;⑤胃潰瘍疑有癌變。
鑒别診斷
主要需要鑒别胃癌,促胃液素瘤等惡性疾病。
預防預後
預後:内科有效治療的發展,預後遠較過去為優,已使消化性潰瘍的死亡率顯着下降至1%以下。30歲以下患者的病死率幾乎等于零;年長着的死亡主要由于并發症,特别是大出血和急性穿孔。