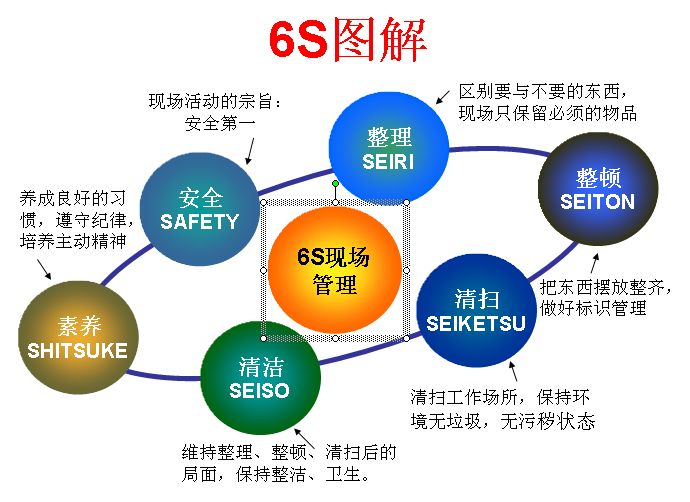
基本内容
微乳液首先由schulman等發現并命名。80年代後作為藥物載體受到醫藥界的重視,國内對這方面的研究剛起步。微乳是由水、油、表面活性劑和助表面活性劑按适當比例混和,自發形成的各向同性、透明、熱力學穩定的分散體系。它已廣泛應用于日用化工、三次采油、酶催化等方面。微乳由于除了具有乳劑的一般特性之外,還具有粒徑小、透明、穩定等特殊優點,在藥物制劑及臨床方面的應用也日益廣泛。 微乳是由水相,油相,表面活性劑與助表面活性劑在适當比例自發形成的一種透明或半透明的,低粘度的,各向同性且熱力學穩定的油水混合系統。
由表面活性劑與助表面活性劑共同起穩定作用。助表面活性劑通常為短鍊醇、氛或其他較弱的兩性化合物。 微乳液液滴可以是分散在水中的油溶脹粒子(O/W微乳液)也可以是分散在油中的水溶脹粒子(W/O)微乳液)或是一種無序的随機結構。可用相圖表示微乳液相行為,如圖1所示在圖中單相區.微乳液是單一的球形液滴(0.01um),因此體系具有光學透明性.此時的液滴可以是O/W型,也可以是W/O型,在中間區域,微乳液呈雙連續結構。微乳液可以許多平衡的相态存在。 微乳則由于其粒徑很小,形成了透明或半透明溶液,因此對其形成機理有不同的觀點。Schulman等認為,在微乳形成過程中,界面張力起着重要的作用。表面活性劑可以使油•水界面張力下降,加入一定量的輔助劑可使油•水界面張力進一步下降,甚至降為負值。Adamson不同意出現負界面張力的說法,他用膠團溶液或膨脹膠束來描述微乳體系。
Friberg把微乳看成是含有普通膠束或反膠束(normaI or inverse micelles)的膠體溶液。Rosano等則認為,乳狀液與微乳之間主要區别在于膠束的類型不同。另外,還有與上述相反的一種觀點,認為當乳狀液粒徑十分小時,相的概念就失去了通常的意義,這時體系的狀态再用相平衡或界面張力的概念來解釋是沒有意義的。 由此可見,關于微乳的本質及形成機理至今看法還不一緻。研究表明,如果在普通乳狀液中增加表面活性劑的用量,并加入相應輔助劑,可以使該現狀液變為微乳;反之,在濃的膠束溶液中加入一定量的油及輔助劑,也可以使此膠束溶液變成微乳。
因此,現在多數人認為微乳是介于普通乳狀液與膠束溶液之間的一種分散體系,是它們相互過渡的産物。因而也有人把微乳稱為膠束乳狀液。但雖然各種看法不一,但有一點是共同的,即微乳液是一種各向同性的熱力學穩定體系.不過它是分子異相體系,水區和油區在亞微觀水平上是分離的,并顯示出各自的本性特性。
微乳的本質及形成機理:關于微乳的本質及形成機理至今看法還不一緻。尚沒有一種理論能完整地解釋微乳的形成。目前影響較大的理論有: 界面張力理論 該理論認為,在微乳形成過程中,界面張力起着重要的作用。表面活性劑可以使O/W界面張力下降,加入一定量的輔助劑可使O/W界面張力進一步下降,甚至降為負值。最終導緻界面增加,微乳形成. 增溶理論 該理論認為微乳是脹大的膠團。膠團和加溶膠團均為熱力學穩定體系,故微乳亦是熱力學穩定體系。但此理論無法解釋為何隻要表面活性劑濃度大于臨界膠團濃度即可發生加溶作用,而此時微乳并不一定能夠形成。 熱力學理論 有人利用熱力學方法求算出微乳形成的白由能及其相轉變的條件來研究微乳的形成條件,但距指導實際工作還相差甚遠。
微乳的制備:微乳制備應滿足3個條件:在油水界面短暫的負界面張力:流動的界面膜:油分子和界面膜的聯系和滲透。微乳液自發形成無需外界做功,主要靠該體系中各種成分的匹配。為了尋找這種匹配關系,目前采用HLB值,相轉換溫度,鹽度掃描等方法。
①鹽度掃描法 主要是研究離子型乳化劑形成ME的條件。由于電解質可降低包圍乳化劑極性端的離子氛圍厚度,從而降低乳化劑分子極性瑞之間的排斥力,在形成ME時可使乳化劑更多地分布于油水界面膜上或油相。在非離子型乳化劑形成的溶液中由于乳化劑帶有較少的電荷,所以電解質對非離子型乳化劑形成ME的相行為影響不如對離子型乳化劑形成的ME的相行為影響明顯。離子型乳化劑在溶液中的分布可用經驗公式表述。鹽度掃描法是固定乳化劑和助乳化劑的濃度,研究不同濃度的電解質對形成ME時相行為的影響。李于佐等在溴化十四烷基吡啶〔TPB〕為乳化劑,正丁醇為助乳化劑,o/w體積比為1:1時,研究了NaCl對相态的影響,結果表明:當TPB為2.0%、正丁醇為4.0%時.NaCI小于2%時形成下相微乳及剩馀油相的二相平衡;NaCI在2.0%一4.5%時.系統為中相微乳、剩馀油相和水相的三相平衡;NaCl大于4.5%時,系統為上相微乳和剩馀水相的二相平衡。形成此現象的原因,可能是随NaCI濃度的增大,使TPB進入油相的量增加,結果下相ME向上相ME轉化。
②相變溫度法(PIT) 溫度對乳化劑在溶液中分布的影響是一複雜過程,對于離子型乳化劑主要表現在影響其親水親油平衡值,以及乳化劑分子之間的靜電排斥力和吸引力,從而影響乳化劑在油、水及油水之間的分布。如十二烷基硫酸鈉在300K時有利于其在水相中分布,高于或低于此溫度有利于其在油相和油水之間分布。對于非離子型乳化劑,溫度可以破壞乳化劑和水形成的氫鍵,從而影響其親水親油平衡值,甚至從親水性乳化劑轉變為親油性乳化劑,或反之。通常溫度對非離子型乳化劑的影響大于離子型乳化劑。相變溫度法是研究在某溫度下乳化劑、助乳化劑及相應的油相形成ME的相行為。以及溫度改變對其相行為的影響。如固相ME給藥系統即是在370C條件下形成的ME ,在常溫下可能已不具備ME的特征,而為固态,但在370C又可恢複到ME的狀态。
③HLB值法 在藥劑學中應用較多的是單相ME,故鹽度掃描法和PIT法的應用受到許多限制。首選方法是根據乳化劑HLB值來研究ME的相态。 ME主要由油、水、乳化劑及助乳化劑組成。在工藝研究中首先應根據油的性質和欲構成ME的類型選擇合适的乳化劑。一般認為HLB值在4—7的乳化劑可形成w/o型ME,在14—20可形成o/w型ME,在7—14時根據工藝條件可形成可轉相的ME。其次選擇合适的助乳化劑。助乳化劑的作用可能是和乳化劑形成複合界面膜,通過助乳化劑的引入可降低乳化劑的相互排斥力及電荷斥力從而使複合凝聚膜具有良好的柔順性。助乳化劑還可調節乳化劑的HLB值。
常用的助乳化劑有低級醇、有機胺、烷基酸及單、雙烷基酸甘油酯及聚氧乙烯脂肪酸酯等。一般認為碳鍊較短的助乳化劑被吸附于乳化劑極性端一例,碳鍊較長的助乳化劑則嵌入在乳化劑的碳鍊中間。一般助乳化劑的效果直鍊的優于有支鍊的,長鍊的優于短鍊的。當助乳化劑鍊長達到乳化劑碳鍊的鍊長時其效果最佳。但也有文獻報道當乳化劑的鍊長(Ls)等于助乳化劑的鍊長(Ln)與油的鍊長(Lo)之和。能使w/o型ME具有最大的載水能力。Lo+Ln>Ls,而w/o型ME有過量的水時,可在下層分離出雙折射水相;Lo十Ls>Ln可在上層分離出各向同性的富油相(abundant oil phase)。同時碳鍊的長短與ME乳摘大小相關。在選定了适當的乳化劑及助乳化劑之後,ME的組成通常采用假二元相圖進行工藝研究,特别是在藥劑學中制備單相ME時。
首先固定油相(水相),作水(油)—乳化劑—助乳化劑三元相圖,求得組成ME的相區。Aboota—zeli等用月桂酸異丙酯為油相,磷脂為乳化劑,分别以正丙醇、異丙醇、正丁醇和異丁醇為助乳化劑,先求得乳化劑和助乳化劑的最佳比值(用比K值表示),再分别按K為1:1、1.5:1、1.77:1、1.94:l,求得ME的相區。 也可根據需要選幾種不同的乳化劑混合使用,可形成固态ME或相變ME。