類型反應
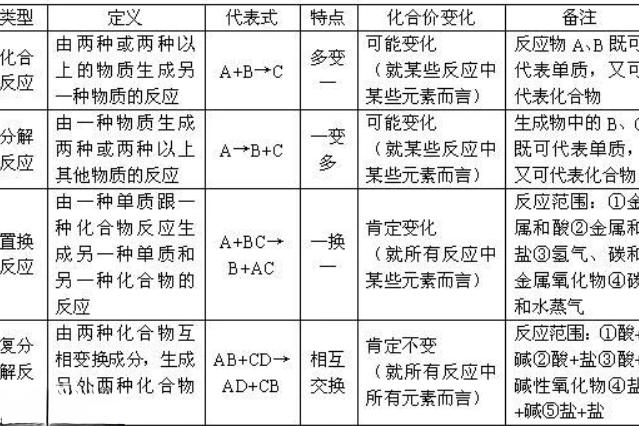
化合反應:由兩種或兩種以上的物質生成一種新物質的反應。其中部分反應
為氧化還原反應,部分為非氧化還原反應。此外,化合反應一般釋放出能量。
分解反應:化學反應的常見類型之一,是化合反應的逆反應。它是指一種化合物分解成二種或二種以上較簡單的單質或化合物的反應。
置換反應:單質與化合物反應生成另外的單質和化合物的化學反應,是化學中四大基本反應類型之一,包括金屬與金屬鹽的反應,金屬與酸的反應等。
複分解反應:由兩種化合物互相交換成分,生成另外兩種化合物的反應。其實質是:發生複分解反應的兩種物質在水溶液中相互交換離子,結合成難電離的物質----沉澱、氣體、水,使溶液中離子濃度降低,化學反應即向着離子濃度降低的方向進行。可簡記為AB+CD=AD+CB。
化合反應
1.金屬+氧氣→金屬氧化物
很多金屬都能跟氧氣直接化合。例如常見的金屬鋁接觸空氣,它的表面便能立即生成一層緻密的氧化膜,可阻止内層鋁繼續被氧化。
如:
2.非金屬+氧氣→非金屬氧化物
經點燃,許多非金屬都能在氧氣裡燃燒,
如:C+O2=點燃=CO2
3.金屬+非金屬→無氧酸鹽
許多金屬能與非金屬氯、硫等直接化合成無氧酸鹽。
如:2Na+Cl2==點燃==2NaCl
4.氫氣+非金屬→氣态氫化物.
因氫氣性質比較穩定,反應一般需在點燃或加熱條件下進行。
如:2H2+O2=點燃=2H2O
多數堿性氧化物不能跟水直接化合。判斷某種堿性氧化物能否跟水直接化合,一般的方法是看對應堿的溶解性,對應的堿是可溶的或微溶的,則該堿性氧化物能與水直接化合。
如:Na2O+H2O=2NaOH.
對應的堿是難溶的,則該堿性氧化物不能跟水直接化合。如CuO、Fe2O3都不能跟水直接化合。
除SiO2外,大多數酸性氧化物能與水直接化合成含氧酸。
如:CO2+H2O=H2CO3
Na2O+CO2=Na2CO3.
大多數堿性氧化物和酸性氧化物可以進行這一反應。其堿性氧化物對應的堿堿性越強,酸性氧化物對應的酸酸性越強,反應越易進行。
氨氣易與氯化氫化合成氯化铵。
如:NH3+HCl=NH4Cl
9.硫和氧氣在點燃的情況下形成二氧化硫
S+O2==點燃==SO2
置換反應
根據反應環境分類
根據反應環境的類别,置換反應有以下2種情況:
(1)固态置換在加熱或高溫條件下固體與固體或固體與氣體發生的置換反應。
(2)液态置換在水溶液中進行的置換反應。
①金屬跟酸的置換
是金屬原子與酸溶液中氫離子之間的反應。
硝酸,它們有強氧化性,先将金屬氧化成對應氧化物,氧化物再溶于酸中,然後繼續氧化,繼續溶解,反應得以繼續
Zn+2HCl====ZnCl₂+H₂↑
Zn+H₂SO₄(稀)====ZnSO₄+H₂↑
2Al+3H₂SO₄(稀)====Al₂(SO₄)₃+3H₂↑
2.金屬跟鹽溶液的置換
是金屬原子跟鹽溶液中較不活潑金屬的陽離子發生置換。如:
Cu+Hg(NO₃)₂====Hg+Cu(NO₃)₂
根據元素性質分類
按元素的性質劃分,金屬與非金屬單質間的置換。
1.金屬單質置換金屬單質
2Al+Fe₂O₃=高溫=Al₂O₃+2Fe(鋁熱反應。Al還可與V₂O₅.CrO₃.WO₃.MnO₂等發生置換)
Fe+CuSO₄=FeSO₄+Cu
2.金屬單質置換非金屬單質
Zn+2HCl=H₂↑+ZnCl₂
2Na+2H₂O=2NaOH+H₂↑
2Mg+CO₂=點燃=2MgO+C
3Fe+4H₂O(g)=高溫=Fe₃O₄+4H₂
4Na+3CO₂=點燃=2Na₂CO₃+C
3.非金屬單質置換金屬單質
C+2CuO=高溫=2Cu+CO₂↑
2F₂+2H₂O=4HF+O₂
2C+SiO₂=Si+2CO↑
C+H₂O=高溫=CO+H₂
2H₂+SiCl₄=Si+4HCl
Cl₂+2NaBr=Br₂+2NaCl
O₂+2H₂S=2S↓+2H₂O
Br₂+2HI=2HBr+I₂
根據元素周期表中位置分類
按元素在周期表的位置劃分,同族元素單質間的置換與不同族元素單質間的置換。
Na+KCl=高溫=NaCl+K↑(一般是774℃)
2Na+2H₂O=2NaOH+H₂↑
2H₂S+O₂=2S+2H₂O
2C+SiO₂=Si+2CO↑
F₂+2HCl=2HF+Cl₂
2.不同主族元素單質間的置換
Mg+2HCl=MgCl₂+H₂↑
2Mg+CO₂=2MgO+C
2Al+6HCl=2AlCl₃+3H₂↑
2F₂+2H₂O=4HF+O₂
C+H₂O(g)==高溫==CO+H₂
2H₂+SiCl₄=Si+4HCl
H₂S+Cl₂=S+2HCl
3Cl₂+8NH₃=6NH₄Cl+N₂
4NH₃+3O₂==點燃==2N₂+6H₂O(氨氣在純氧中燃燒)
2Al+Fe₂O₃=Al₂O₃+2Fe
C+CuO=Cu+CO
4Na+TiCl₄=4NaCl+Ti
4.副族元素的單質置換主族元素單質
3Fe+4H₂O(g)==加熱==Fe₃O₄+4H₂
5.副族元素的單質置換副族元素的單質
Fe+CuSO₄=FeSO₄+Cu
根據物質類别分類
按物質類别劃分,單質與氧化物間的置換和單質與非氧化物間的置換。
1.單質與氧化物發生置換反應
2Na+2H₂O=2NaOH+H₂↑
2Mg+CO₂=點燃=2MgO+C
3Fe+4H₂O=Fe₃O₄+4H₂
C+FeO=高溫=Fe+CO↑
2F₂+2H₂O=4HF+O₂↑
2C+SiO₂=Si+2CO↑
2Al+Fe₂O₃=Al₂O₃+2Fe
C+H₂O(g)=高溫=CO+H₂
Si+2FeO=2Fe+SiO₂
2.單質與非氧化物發生置換反應
2H₂+SiCl₄=Si+4HCl
H₂S+Cl₂=S+2HCl
3Cl₂+8NH₃=6NH₄Cl+N₂
4NH₃+3O₂=2N₂+6H₂O
Mg+2HCl=MgCl₂+H₂
2Al+6HCl=2AlCl₃+3H₂
液态置換遵守金屬活動性順序。
氧化還原反應不一定為置換反應,置換反應一定為氧化還原反應。
另外需要注意的是置換反應是根據金屬活潑性順序表發生的。
複分解反應
酸與鹽
反應時酸完全可以不溶,例如矽酸溶于碳酸鈉濃溶液
如:2HCl+CaCO₃=CaCl₂+H₂O+CO₂↑(生成H₂CO₃和CaCl₂,H₂CO₃不穩定分解成H₂O和CO₂)
BaCl₂+H₂SO₄=BaSO₄↓+2HCl
AgNO₃+HCl=AgCl↓+HNO₃
注:大多數酸都可以與碳酸鹽(碳酸氫鹽)反應,生成新鹽,水和二氧化碳。(以鈉鹽為例)
如:Na₂CO₃+2HCl=2NaCl+H₂O+CO₂↑(生成H₂CO₃和NaCl,H₂CO₃不穩定分解成H₂O和CO₂)
Na₂CO₃+H₂SO₄=Na₂SO₄+H₂O+CO₂↑(生成H₂CO₃和Na₂SO₄,H₂CO₃不穩定分解成H₂O和CO₂)
NaHCO₃+HCl=NaCl+H₂O+CO₂↑(生成H₂CO₃和NaCl,H₂CO₃不穩定分解成H₂O和CO₂)
2NaHCO₃+H₂SO₄=Na₂SO₄+2H₂O+2CO₂↑(生成H₂CO₃和Na₂SO₄,H₂CO₃不穩定分解成H₂O和CO₂)
酸與堿
反應物中至少有一種是可溶的。
如:H₂SO₄+Cu(OH)₂=CuSO₄+2H₂O
H₂SO₄+Ca(OH)₂=CaSO₄↓+2H₂O
H₂SO₄+2NaOH=Na₂SO₄+2H₂O
H₂SO₄+Ba(OH)₂=BaSO₄↓+2H₂O
2HCl+Cu(OH)₂=CuCl₂+2H₂O
2HCl+Ca(OH)₂=CaCl₂+2H₂O
HCl+NaOH=NaCl+H2O
2HCl+Ba(OH)₂=BaCl₂+2H₂O
鹽與鹽(可溶)
反應時一種鹽完全可以不溶,生成物至少有一種不溶(除非産生氣體),例如硫酸氫鈉溶解碳酸鎂
如:Na₂SO₄+BaCl₂=2NaCl+BaSO₄↓
Na₂CO₃+CaCl₂=2NaCl+CaCO₃↓
Na₂CO₃+BaCl₂=2NaCl+BaCO₃↓
鹽與堿
反應時鹽和堿均可溶于水,堿難溶的例子見于硫酸氫鹽溶解氫氧化鎂,鹽難溶的例子見于氫氧化鈉溶解硫酸鉛
如:2NaOH+CuSO₄=Na₂SO₄+Cu(OH)₂↓
NaOH+NH₄Cl=NaCl+NH₃↑+H₂O
Na₂CO₃+Ca(OH)₂=CaCO₃↓+2NaOH
3NaOH+FeCl₃====Fe(OH)₃↓+3NaCl
Fe(OH)₂與NaCl不會發生反應
Fe(OH)₃與NaCl也不會發生反應
酸與金屬氧化物
例如:鹽酸除鐵鏽:Fe₂O₃+6HCl=2FeCl₃+3H₂O
注意:氯離子對反應有促進作用,硫酸根離子對反應有抑制作用
(6)特例:NaOH+Al(OH)₃═NaAlO₂+2H₂O
3.方法:
概括上述四種類型的複分解反應能夠發生并趨于完成的條件,可分成兩方面記憶掌握。一方面是對反應物的要求:酸鹽、酸堿一般行,鹽鹽、鹽堿都需溶;另一方面是對生成物的要求:生成物中有沉澱析出或有氣體放出,或有水等弱電解質生成。這兩方面必須兼顧,才能正确地書寫有關複分解反應的化學方程式。