概念
所謂光化學反應是指由一個原子、分子、自由基或離子吸收一個光子所引發的化學反應。
類型
有機合成中的反應
有機合成中常見的光化學反應有光氧化反應、光還原反應、光聚合反應和光取代反應等。
光氧化反應是在光照射、光敏劑作用下,有機物分子與氧繁盛的加成反應。光氧化反應條件溫和,不需要化學劑和重金屬催化劑,在藥物、香精、洗滌劑和染料等精細化學品的合成方面已屢見報道。
光還原反應是在光催化下,有機物分子從供氧體中抽取氫分子而發生的還原反應。研究較多的是羟基化合物的光還原反應,例如雙苯酮在二苯甲醇中發生光還原反應可得到四苯基乙醇。
光取代反應常見的是脂肪烴的光濾代制氯代烴,如CH4氯代為一氯代甲烷、二氯甲烷、氯仿和四氯化碳。t通過光取代反應可制備多種清潔劑、殺蟲劑、抗氧劑和中間體,這些反應具有較其他途徑溫和、回收率高和選擇性好等特點,有的産物甚至是非光氯化反應所不能産生的,因而在工業生産上極有潛力。
環境化學中的反應
因人類生活和生産造成的環境污染正困擾着人類,如大海漂浮的油污正在危害我們的海洋資源:廢棄的塑料制品正在給人類帶來一場白色污染;汽車排出的尾氣時刻威脅我們的身體健康等。環境化學中的光化學反應主要有光氧化反應、光降解反應和光氧-微生物降解反應。
光氧化降解反應是在光作用下,氧化将有機物分子如芳醛、芳醇和芳烴氧化為氫過氧化物。氫過氧化物易溶于水,因具有很高的生物化學活性而已被消化掉,脂肪族有機化合物也可被氧化成小分子酸、醛甚至能被深度降解為CO2、H2O,直接進入自然界的生物循環。
微生物化學也是環境化學的一個重要分支,在有機合成和廢物處理等領域都有着廣泛的應用且成效顯著。光氧-微生物降解存在應用面窄的缺點,所降解塑料需要具有光敏基團或易與微生物作用的結構,因而其應用也受到一定的條件限制。但從塑料産業的發展趨勢看,降解塑料的代替傳統塑料應用于包裝行業及農業是必然的。
原理
光化學反應在環境中主要是受陽光的照射,污染物吸收光子而使該物質分子處于某個電子激發态,而引起與其它物質發生的化學反應。如光化學煙霧形成的起始反應是二氧化氮(NO2)在陽光照射下,吸收紫外線(波長2900~4300A)而分解為一氧化氮(NO)和原子态氧(O,三重态)的光化學反應,由此開始了鍊反應,導緻了臭氧及與其它有機烴化合物的一系列反應而最終生成了光化學煙霧的有毒産物,如光氧乙酰硝酸酯(PAN)等。
大氣污染的化學原理比較複雜,它除了與一般的化學反應規律有關外,更多的由于大氣中物質吸收了來自太陽的輻射能量(光子)發生了光化學反應,使污染物成為毒性更大的物質(叫做二次污染物)。光化學反應是由物質的分子吸收光子後所引發的反應。分子吸收光子後,内部的電子發生能級躍遷,形成不穩定的激發态,然後進一步發生離解或其它反應。一般的光化學過程如下:
(1)引發反應産生激發态分子(A*)
A(分子)+hv→A*
(2)A*離解産生新物質(C1,C2…)
A*→C1+C2+…
(3)A*與其它分子(B)反應産生新物質(D1,D2…)
A*+B→D1+D2+…
(4)A*失去能量回到基态而發光(熒光或磷光)
A*→A+hv
(5)A*與其它化學惰性分子(M)碰撞而失去活性
A*+M→A+M′
反應(1)是引發反應,是分子或原子吸收光子形成激發态A*的反應。引發反應(1)所吸收的光子能量需與分子或原子的電子能級差的能量相适應。物質分子的電子能級差值較大,隻有遠紫外光、紫外光和可見光中高能部分才能使價電子激發到高能态。即波長小于700nm才有可能引發光化學反應。産生的激發态分子活性大,可能産生上述(2)~(4)一系列複雜反應。反應(2)和(3)是激發态分子引起的兩種化學反應形式,其中反應(2)于大氣中光化學反應中最重要的一種,激發分子離解為兩個以上的分子、原子或自由基,使大氣中的污染物發生了轉化或遷移。反應(4)和(5)是激發态分子失去能量的兩種形式,結果是回到原來的狀态。
大氣中的N2,O2和O3能選擇性吸收太陽輻射中的高能量光子(短波輻射)而引起分子離解:
N2+hv→N+N λ<120 nm
O2+hv→O+O λ<240 nm
O3+hv→O2+O λ=220~290 nm
顯然,太陽輻射高能量部分波長小于290nm的光子因被O2,O3,N2的吸收而不能到達地面。大于800nm長波輻射(紅外線部分)幾乎完全被大氣中的水蒸氣和CO2所吸收。因此隻有波長300~800nm的可見光波不被吸收,透過大氣到達地面。
大氣的低層污染物NO2、SO2、烷基亞硝酸(RONO)、醛、酮和烷基過氧化物(ROOR′)等也可發生光化學反應:
NO2+bv→NO·+O
HNO2(HONO)+hv→NO+HO·
RONO+hv→NO·+RO·
CH2O+hv→H·+HCO
ROOR′+hv→RO·+R′O·
上述光化學反應光吸收一般在300~400nm。這些反應與反應物光吸收特性,吸收光的波長等因素有關。應該指出,光化學反應大多比較複雜,往往包含着一系列過程。
作用
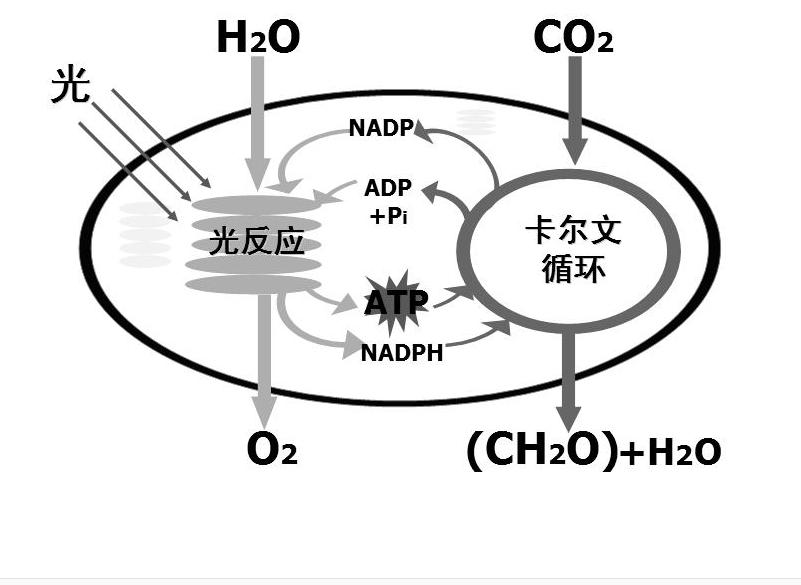
光化學反應可引起化合、分解、電離、氧化還原等過程。主要可分為兩類:一類是光合作用,如綠色植物使二氧化碳和水在日光照射下,借植物葉綠素的幫助,吸收光能,合成碳水化合物。另一類是光分解作用,如高層大氣中分子氧吸收紫外線分解為原子氧;染料在空氣中的褪色,膠片的感光作用等。
基本定律
光化學第一定律
隻有被體系内分子吸收的光,才能有效地引起該體系的分子發生光化學反應,此定律雖然是定性的,但卻是近代光化學的重要基礎。該定律在1818年由Grotthus和Draper提出,故又稱為Grotthus-Draper定律.
光化學第二定律
在初級過程中,一個被吸收的光子隻活化一個分子.該定律在1908~1912年由Einstein和Stark提出,故又稱為Einstein-Stark定律.
Beer-Lambert定律
平行的單色光通過濃度為c,長度為d的均勻介質時,未被吸收的透射光強度It與入射光強度I0之間的關系為(e為摩爾消光系數)