操作步驟
裝置選擇
1.用高錳酸鉀或氯酸鉀制氧氣選甲裝置:固體與固體加熱制氣體(實驗室常用說法:固固加熱型);
2.用過氧化氫制氧氣選乙裝置:液體與固體不加熱制氣體(實驗室常用說法:固液常溫型)。
方法步驟
高錳酸鉀制取氧氣
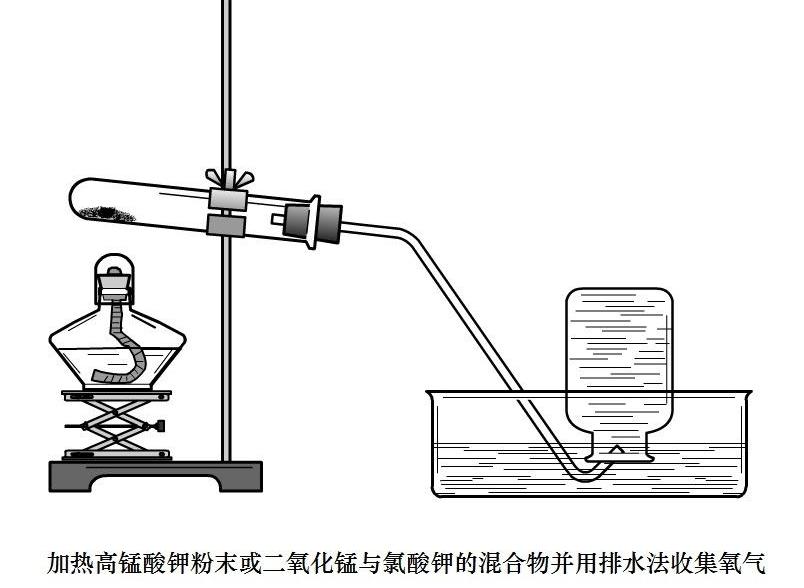
步驟:查—裝—定—點—收—移—熄;
查——檢查裝置的氣密性;
裝——裝藥品;
定——把試管固定到鐵架台上;
點——點燃酒精燈加熱(先預熱,注意:一律先讓試管均勻受熱,否則會因冷熱不均炸裂試管);
收——收集氣體(可以使用排水法、向上排空氣法);
移——把導管從水槽中取出(如果使用向上排空氣法,此步驟基本不需要,但是最好先取出導管在蓋上玻片);
熄——熄滅酒精燈。
注意點:
①試管口略向下傾斜:防止冷凝水倒流回試管底部炸裂試管;
②藥品平鋪在試管的底部:先預熱,之後可以将酒精燈的外焰對準裝有藥品部位定向加熱;
③鐵夾夾在離管口約1/3處;
④導管應稍露出橡皮塞:便于氣體排出(大約0.5cm);
⑤試管口應放一團棉花:防止高錳酸鉀粉末進入導管并堵塞導管,使所制得氣體無法較好排出;
⑥排水法收集時,待氣泡均勻連續冒出時再收集(剛開始排出的是試管中的空氣,此時收集氣體不純);
⑦實驗結束時,先移走導管,再熄滅酒精燈:防止水槽中的冷水倒吸進熱的試管引起試管炸裂;
⑧用向上排空氣法收集氣體時,導管伸到集氣瓶底部:以便把空氣排盡。
過氧化氫(雙氧水)制氧氣
步驟:查——裝——收;
查——檢查裝置的氣密性:用夾子把導管夾上(應使用兩節導管,中間用較短橡皮管連接,便于檢查),然後往長頸漏鬥中加水,長頸漏鬥的頸部中的水柱如不下降,說明氣密性良好;
裝——裝藥品,先裝固體,後裝液體(防止液體飛濺);
收——收集氣體(同上高錳酸鉀收集法)。
注意點:
①長頸漏鬥的頸部應在液面以下(液封):防止氣體從長頸漏鬥洩露,可用分液漏鬥代替(可控制反應速率);
②導管應稍露出橡皮塞:便于氣體排出。
氧氣檢驗
檢驗方法:
檢驗:用帶火星的木條伸入集氣瓶内,如果木條複燃,證明是O2。
驗滿:用帶火星的木條放在集氣瓶瓶口,如果木條複燃,證明O2已滿。
排水法:
當集氣瓶瓶口冒氣泡時(剛開始排出的是試管中的空氣,等氣泡連續均勻冒出時,才是純氧);
實驗室制取氧氣是初級化學的一個實驗,通常二氧化錳是催化劑,實驗完畢後,可以用過濾法回收。
向上排氣法(O2密度大于空氣)。
文字表達
實驗室制取氧氣方法主要有三種,其文字表達式如下:
高錳酸鉀————→錳酸鉀+二氧化錳+氧氣(加熱)
氯酸鉀————→氯化鉀+氧氣(二氧化錳做催化劑)
過氧化氫+二氧化錳—→水+氧氣(二氧化錳做催化劑、加熱)
制氧口訣
二氧化錳氯酸鉀;混和均勻把熱加。
制氧裝置有特點;底高口低略傾斜。
二氧化錳
二氧化錳MnO2
一種兩性氧化物.它是一種常溫下非常穩定的黑色或棕色粉末狀固體為軟錳礦的主要成分,密度5.0g/cm3不溶于水,是最重要的一種錳的氧化物。氧化錳粉塵可引起人的錳塵肺。高價錳氧化物,不論侵入機體的途徑,其毒性作用對大腦有損傷。
遇還原劑時,表現為氧化性。如将二氧化錳放到氫氣流中加熱至1400K得到一氧化錳;将二氧化錳放在氨氣流中加熱,得到棕黑色的三氧化二錳;将二氧化錳跟濃鹽酸反應,則得到二氯化錳和氯氣。
遇強氧化劑時,還表現為還原性。如将二氧化錳,碳酸鉀和硝酸鉀或氯酸鉀混合熔融,可得到暗綠色熔體,将熔體溶于水冷卻可得六價錳的化合物錳酸鉀。在酸件介質中是一種強氧化劑。
大量用于煉鋼,并用于制玻璃,陶瓷,搪瓷,幹電池以及用作催化劑等。
二氧化錳也被用作顔料、有色玻璃等。