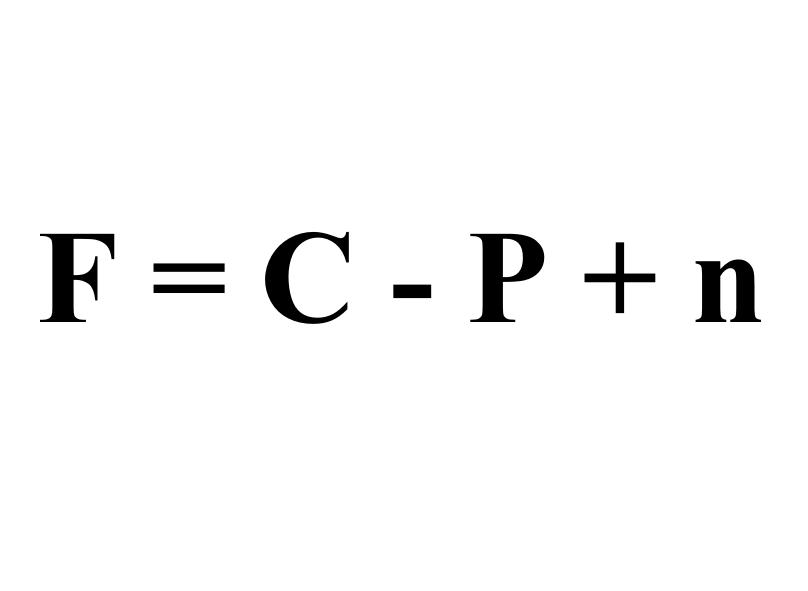定義
熱力學平衡條件下系統的組分數、相數和自由度數之間的關系。f=c-P+n,式中c是系統的獨立組分數,P是系統的相數,n是除濃度變量外影響系統狀态的其他強度性質數(如溫度、壓力等),f為系統的自由度數。
定律詳解
在物理化學,吉布斯相律說明了在特定相态下,系統的自由度跟其他變量的關系。
吉布斯相律是相圖的基本原理,它指出:
F = C - P + n
其各個字母表示的含義分别為:
F:自由度
C:系統的組元數(例如化合物的數目)
P:在該點的相态數目
n:外界因素,多數取n=2,代表壓力和溫度;對于熔點極高的固體,蒸汽壓的影響非常小,可取n=1。
以水為例子,隻有一種化合物,C=1。在三相點,P=3。F=1-3+2=0,所以溫度和壓力都固定。
當兩種态處于平衡,P=2,對應一個特定壓力,便恰好有一個熔點,即有一個自由度。吉布斯相律的預言正确:F=1-2+2=1。
吉布斯相律廣泛适用于多相平衡體系,若兩相平衡時,壓強不相等,則,吉布斯相律不适用。如滲透平衡。
意義及地位
吉布斯的“相律”對于多相體系是具有高度概括性的普适規律,雖然是抽象的,但卻是最本質的熱力學關系。在“相律”提出前後的一個時期内,曾有一些學者甚至是一些著名學者對相平衡間題獨立地作過研究,也得出一些規律,如早期的拉烏爾定律、亨利定律以及“相律”提出後但被埋沒的十幾年裡,比吉布斯出名得多的範霍夫和赫姆霍茲也曾不同程度地進行了研究工作。但這些人的工作都不過是“相律”的某些特例,可見吉布斯的優先權和詳盡性是毋容置疑的。
吉布斯相律雖然是研究物質聚集狀态之間的相态轉變及其平衡的規律,本質上是分子整體運動,應屬于分子物理學範疇;但是不同相态(物相)的分子之間的轉變,在一定意義上也可視為分子性質的質變,則屬于化學範躊。從相變過程在學科發展的曆史來看,它一直是化學家研究的世襲領地,因而成為邊緣學科—物理化學的一個基本内容。吉布斯相律的重要意義就在于推動了化學熱力學及整個物理化學的發展,也成為相關領域諸如冶金學和地質學等的重要理論工具。