病症簡介
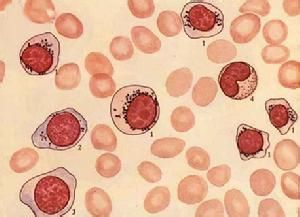
MDS是一組克隆性造血幹細胞疾病,其特征為血細胞減少,髓系細胞一系或多系病态造血,無效造血及高風險向白血病轉化。國際預後評分系統(IPSS)推薦的血細胞減少的标準為Hb<100g/L,中性粒細胞絕對值(ANC)<1.8×10^9/L,血小闆(PLT)<100×10^9/L,但實際診斷MDS時,不要求一定達到這麼低。多數MDS病例以進行性的骨髓衰竭為特征,并最終都會發展成為AML,但是不同亞型轉白率也不同,某些患者的生物學特征是相對惰性的,病程較長,轉白率很低。
在MDS定義明确後,診斷和分型中主要難點在那些外周血和骨髓原始細胞不增多病例上,尤其當病态造血不顯著時;或與營養缺乏、化學藥物、中毒、造血生長因子、炎症及感染繼發的病态造血鑒别;以及骨髓低增生或伴随纖維化等情況,不能獲得足夠細胞分析可能的疾病過程。低增生性MDS及MDS伴骨髓纖維化診斷常常很困難。
病因
MDS病因未明。
診斷
診斷流程
注:VitB12:維生素B12,FA:葉酸,Epo:促紅細胞生成素,PAS:過碘雪夫酸染色,POX:過氧化酶,FISH:熒光原位雜交,PDGFR:血小闆衍生生長因子受體,HIV:人類免疫缺陷病毒,PNH:陣發性睡眠性血紅蛋白尿症,LGL:大顆粒淋巴細胞白血病
診斷标準
建議參照維也納标準(表2)。MDS診斷需要滿足兩個必要條件和一個确定标準。
當患者未達到确定标準,如:不典型的染色體異常,病态造血<10%,原始細胞比例4%等,而臨床表現高度疑似MDS,如輸血依賴的大細胞性貧血,應進行MDS輔助診斷标準的檢測(見表2),符合者基本為伴有骨髓功能衰竭的克隆性髓系疾病,此類患者診斷為高度疑似MDS。若輔助檢測未能夠進行,或結果呈陰性,則對患者進行随訪,或暫時歸為意義未明的特發性血細胞減少症(idiopathic cytopenia of undetermined significance, ICUS),定期檢查以明确診斷。
MDS的形态學異常
原始細胞标準:Ⅰ型為無嗜天青顆粒的原始細胞,Ⅱ型為含有嗜天青顆粒但未出現核旁高爾基區的原始細胞。出現核旁高爾基區者則為早幼粒細胞。
病理活檢是骨髓塗片的必要補充(表4)。要求在髂後上棘取骨髓組織長度不得少于1.5cm。所有懷疑為MDS的患者均應進行免疫組化(immunohistochemical, IHC)檢測(表5)。
細胞遺傳學檢測
對所有懷疑MDS的患者均應進行染色體核型檢測,需檢測20~25個骨髓細胞的中期分裂相(表6)。對疑似MDS者,染色體檢查失敗時,進行FISH檢測,至少包括:5q31、CEP7、7q31、CEP8、20q、CEPY和p53。
對懷疑MDS疾病進展者,在随訪中應檢測染色體核型,一般6~12月檢查一次。
基因表達譜和點突變檢測
在MDS中,基于CD34+細胞或CD133+細胞的基因表達譜(gene expression profiling, GEP)的檢測,能發現特異的,有預後意義的,并與FAB、WHO或IPSS亞型存在一定相關性的基因标記。但是在高危MDS與繼發性AML,低危MDS與正常人間,這些GEP異常存在重疊。
對于懷疑有肥大細胞增多症或伴有血小闆增多症者,檢測KIT基因D816V突變或JAK2基因V617F突變有助于鑒别診斷。
流式細胞技術在MDS中應用
目前尚未發現MDS患者特異性的抗原标志或标志組合,但流式細胞術在反應性骨髓改變與克隆性髓系腫瘤患者的鑒别診斷中有意義。
鑒别診斷
診斷MDS的主要問題是要确定骨髓增生異常是否由克隆性疾病或其它因素所導緻。病态造血本身并不是克隆性疾病的确切證據。
(1)營養性因素,中毒或其它原因可以引起病态造血的改變,包括Vit B12和FA缺乏,人體必需元素的缺乏以及接觸重金屬,尤其是砷劑和其他一些常用的藥物、生物試劑等。
(2)先天性血液系統疾病,如先天性紅細胞生成異常性貧血(CDA)可引起紅系病态造血。微小病毒B19感染可以引起幼稚紅細胞減少,并伴有巨大巨幼樣的幼稚紅細胞。免疫抑制劑麥考酚酸酯也可以導緻幼稚紅細胞減少。
(3)藥物因素,複方新諾明可以導緻中性粒細胞核分葉減少,易與MDS中的病态造血相混淆。化療可引起顯著的髓系細胞病态造血。G-CSF會導緻中性粒細胞形态學的改變,如胞質顆粒顯著增多,核分葉減少;外周血中可見原始細胞,但很少超過10%,骨髓中原始細胞比例一般正常,但是也可以升高。
了解臨床病史包括藥物和化學試劑的接觸史很重要,鑒别骨髓增生異常時,尤其是原始細胞不高的病例,要考慮非克隆性疾病。若診斷困難,可在幾個月後再行骨髓及細胞遺傳學檢查。
(4)其他血液疾病
再生障礙性貧血與MDS鑒别。RA的網織紅細胞可正常或升高,外周血可見到有核紅細胞,骨髓病态造血明顯,早期細胞比例不低或增加,染色體異常,而再生障礙性貧血一般無上述異常。
PNH也可出現全血細胞減少和病态造血,但PNH檢測可發現CD55+、CD59+細胞減少,Flaer可發現粒細胞和單核細胞的GPI錨連蛋白缺失,Ham試驗陽性及血管内溶血的改變。
自身抗體導緻的全血細胞減少,也能見到病态造血,Coombs試驗陽性和流式細胞術能檢測到造血細胞相關自身抗體,而且應用糖皮質激素、免疫抑制劑常于短期内出現較好的治療反應。
(5)甲狀腺疾病也可出現全血細胞減少和病态造血,但甲狀腺功能檢查異常。
(6)實體腫瘤也可出現全血細胞減少和病态造血,可行相關檢查排除。
分型
1982年FAB協作組提出以形态學為基礎的FAB标準(表8),主要根據MDS患者外周血和骨髓細胞病态造血、特别是原始細胞比例、環形鐵粒幼細胞數、Auer小體及外周血單核細胞數量,将MDS分為5型:難治性貧血(refractory anemia,RA)、環形鐵粒幼細胞性難治性貧血(RA with ringed sideroblasts,RAS)、難治性貧血伴原始細胞增多(RA with excess blasts,RAEB)、難治性貧血伴原始細胞增多轉化型(RAEB in transformation,RAEB-t)、慢性粒-單核細胞白血病(chronic myelomonocytic leukemia,CMML)。
1997年WHO開始修訂FAB的分型方案,于2001年發表。WHO分類已被廣泛接受,并得到多個獨立研究組的證實。最新的2008年WHO分類包括以下變化(表9):
(1)對标本采集、原始細胞和原始細胞系的分析、遺傳學改變的分析都做了明确指導,
(2)MDS/MPN的診斷和區分,
(3)将具有MDS主要的特異性改變,如血細胞減少,但是骨髓中沒有明确的形态學證據,稱為待定MDS,
(4)增列了難治性血細胞減少伴單系病态造血的亞型,
(5)将伴有多系病态造血的環形鐵粒幼細胞(RCMD-RS)歸入RCMD。
①兩系血細胞減少偶見,全血細胞減少應診斷為MDS-U。
②如果骨髓中原始細胞<5%,外周血中2-4%,則診斷為RAEB-1。如RCUD和RCMD患者外周血原始細胞為1%,應診斷為MDS-U。
③伴有Auer小體,原始細胞在外周血中<5%,骨髓中<10%,應診斷為RAEB-2
治療
MDS治療主要解決兩大問題:骨髓衰竭及并發症、AML轉化。就患者群體而言,MDS患者自然病程和預後的差異性很大,治療宜個體化。根據MDS患者的預後積分,同時結合患者年齡、體能狀況、依從性等進行綜合評定,選擇治療方案。低危組MDS治療包括成分血輸注,造血因子治療,免疫調節劑,表觀遺傳學藥物治療。低危組患者一般不推薦化療及造血幹細胞移植,但年輕低危組患者能耐受高強度治療,有望産生更好的效果/風險比和無進展生存及總生存率。
高危組MDS預後較差,易轉化為AML,需要高強度治療,包括化療和造血幹細胞移植。高強度治療有較高的治療相關并發症和死亡率,不适合所有患者。
支持治療
包括輸血、促紅細胞生成素(Epo)、粒細胞集落刺激因子(G-CSF)或粒-巨噬細胞集落刺激因子(GM-CSF)。為大多數高齡MDS、低危MDS所采用。支持治療的主要目的是改善MDS症狀、預防感染出血和提高生活質量。
1、輸血
除MDS自身疾病原因導緻貧血以外,其他多種因素可加重貧血,如營養不良、出血、溶血和感染等。在改善貧血中,這些因素均應得到處理。
一般在Hb<60g/L,或伴有明顯貧血症狀時輸注紅細胞。老年、代償反應能力受限、需氧量增加,可放寬輸注,不必Hb<60g/L。
2、去鐵治療
接受輸血治療,特别是紅細胞輸注依賴的MDS患者的鐵超負荷若未采取治療或治療不當,可導緻總生存期縮短。
血清鐵蛋白(SF)測定評價鐵超負荷,能間接反映機體鐵負荷,但SF水平波動較大,易受感染、炎症、腫瘤、肝病及酗酒等影響。對于紅細胞輸注依賴患者,應每年監測3~4次SF。接受去鐵治療的患者,應依所選藥物的使用指南進行鐵負荷監測,并定期評價受累器官功能。
去鐵治療(iron chelation therapy, ICT)可以降低SF水平、肝髒和心髒中鐵含量,治療有效與藥物使用時間、劑量、患者耐受性及同時的輸血量有關。SF降至500 μg/L以下且患者不再需要輸血時可終止去鐵治療,若去鐵治療不再是患者的最大收益點時也可終止去鐵治療。常用藥物有:去鐵胺、去鐵酮、地拉羅司。
3、血小闆輸注
建議存在血小闆消耗危險因素者(感染、出血、使用抗生素或抗人胸腺細胞免疫球蛋白等)輸注點為20×10^9/L,而病情穩定者輸注點為10×10^9/L。
4、促中性粒細胞治療
中性粒細胞缺乏患者,可給予G-CSF/GM-CSF,以使中性粒細胞>1×10^9/L。不推薦MDS常規使用抗生素預防感染治療。
5、促紅系生成治療
Epo是低危MDS、輸血依賴者主要的初始治療,加用G-CSF可以增加紅系反應,持續6周。對無反應者,可加量Epo應用,繼續治療6周。對治療有反應者,一旦取得最大療效,逐漸減量G-CSF、Epo的應用,直至用最小的劑量維持原療效。
免疫抑制治療(IST)
ATG單藥或聯合環孢素進行IST選擇以下患者可能有效:無克隆性證據的≤60歲的低危/中危-1患者,或者骨髓低增生,HLA-DR15或伴小的PNH克隆。不推薦原始細胞>5%,伴染色體-7或者複雜核型者使用IST。
近有前瞻性随機對照的研究發現IST與最佳支持治療生存期相當。對于MDS采用抑制T細胞功能的治療需慎重。
免疫調節治療
免疫調節藥物(IMiDs)
沙利度胺(thalidomide)治療後血液學改善以紅系為主,療效持久,但中性粒細胞和血小闆改善罕見。尚沒能夠證實劑量與反應率間的關系,長期應用耐受性差。
來那度胺(lenalidomide)對染色體5q-異常者效果很好,但是标準劑量(來那度胺10mg/d,共21天)骨髓抑制比例高;對于複雜染色體異常和伴p53基因突變者,使用來那度胺會導緻疾病進展,促進轉白。建議5q-患者先使用Epo,無效後換用來那度胺。在使用來那度胺前和過程中檢測染色體和p53的突變情況。
表觀遺傳學修飾治療
5-阿紮胞苷(Azacitidine,AZA)和5-阿紮-2-脫氧胞苷(Decitabine,地西他濱)可降低細胞内DNA總體甲基化程度,并引發基因表達改變。兩種藥物低劑量時有去甲基化作用,高劑量時有細胞毒作用。阿紮胞苷和地西他濱在MDS治療中的具體劑量方案仍在優化中。高危MDS患者,是應用去甲基化藥物的适宜對象;對于低危患者并發嚴重血細胞減少和/或輸血依賴,也是去甲基化藥物治療的合适對象。療程增加可提高AZA或地西他濱治療有效率。
1、阿紮胞苷(AZA)
MDS中高危患者應用AZA 75mg/m2皮下注射或靜脈輸注共7天,28天為1療程為目前推薦方案。
AZA可明顯改善患者生活質量,減少輸血需求,明顯延遲高危MDS患者向AML轉化或死亡的時間。即使患者未達CR,AZA也能改善生存。
在毒性能耐受及外周血象提示病情無進展的前提下,AZA治療6個療程無改善者,換用其他藥物。
2、地西他濱
地西他濱推薦方案為每天20mg/m2靜脈輸注,共5天,4周1療程。
多數患者在第2療程結束起效,并且在同一時間點達到最佳效果。通常足量應用地西他濱3~4療程若無效再考慮終止治療。
細胞毒性化療
高危組尤其原始細胞增高亞型的MDS預後相對較差,開始宜行類同于AML的治療,完全緩解率40-60%,但是緩解時間短暫。年老者常難以耐受。年輕(<65歲)、核型正常者化療後5年總生存率約27%。
預激方案在小劑量Ara-c(10mg/m2,q12hs×14d)基礎上加用G-CSF,并聯合阿克拉黴素(ACR)或高三尖杉酯堿(HHT)或去甲氧柔紅黴素(Ida)。國内多使用預激方案,由于MDS多見于老年人群,機體狀況較差或常伴有諸如慢性肺病、心血管病及糖尿病等不适于強化療的因素,因此小劑量化療為這些患者延長生存期,改善生活質量提供了一種治療選擇。治療MDS的CR率40%-60%左右,有效率60%-70%。年齡對于療效無顯著影響,但年齡≥60歲的患者對化療耐受較差。
造血幹細胞移植
異基因造血幹細胞移植(Allo-HSCT)可能治愈MDS,但随年齡增加移植相關并發症也有所增加。适應證如下:
1 FAB分類中的RAEB、RAEB-t、CMML及MDS轉化的AML患者生存期短,是Allo-HSCT的适應證。
2 IPSS系統中的中危-2及高危MDS是進行Allo-HSCT的适應證。IPSS高危染色體核型的患者預後差,宜進行Allo-HSCT。
3 嚴重輸血依賴,且有明确克隆證據的低危組患者,應該在器官功能受損前進行Allo-HSCT。
4 MDS患者有強烈移植意願。
療效和随訪
MDS國際工作組(International Working Group, IWG)于2000年提出國際統一療效标準,2006年又做了進一步修訂,使不同臨床治療方案結果間具有可比性。MDS的治療主要目的:改變自然病程和改善生存質量(表10),以此評價療效。