發現曆史
苯酚是德國化學家龍格(Runge F)于1834年在煤焦油中發現的,故又稱石炭酸(Carbolic acid)。使苯酚首次聲名遠揚的應歸功于英國著名的醫生裡斯特。裡斯特發現病人手術後死因多數是傷口化膿感染。偶然之下用苯酚稀溶液來噴灑手術的器械以及醫生的雙手,結果病人的感染情況顯著減少。這一發現使苯酚成為一種強有力的外科消毒劑。裡斯特也因此被譽為“外科消毒之父”。
分子結構
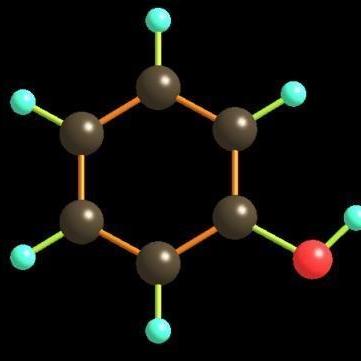
苯酚分子由一個羟基直接連在苯環上構成。由于苯環的穩定性,這樣的結構幾乎不會轉化為酮式結構。
苯酚共振結構如圖。酚羟基的氧原子采用sp2雜化,提供一對孤電子與苯環的6個碳原子共同形成離域鍵。大π鍵加強了烯醇的酸性,羟基的推電子效應又加強了O-H鍵的極性,因此,苯酚中羟基的氫可以電離出來。
分子結構數據
摩爾折射率:28.13
摩爾體積(cm3/mol):87.8
等張比容(90.2K):222.2
表面張力(dyne/cm):40.9
極化率(10-24cm3):11.15
物理性質
密度:1.071g/cm3
熔點:43℃
沸點:182℃
閃點:72.5℃
折射率:1.553
飽和蒸氣壓:0.13kPa(40.1℃)
臨界溫度:419.2℃
臨界壓力:6.13MPa
引燃溫度:715℃
爆炸上限(V/V):8.5%
爆炸下限(V/V):1.3%
溶解性:微溶于冷水,可混溶于乙醇、醚、氯仿、甘油
化學性質
可吸收空氣中水分并液化。有特殊臭味,極稀的溶液有甜味。腐蝕性極強。化學反應能力強。與醛、酮反應生成酚醛樹脂、雙酚A,與醋酐;水楊酸反應生成醋酸苯酯、水楊酸酯。還可進行鹵代、加氫、氧化、烷基化、羧基化、酯化、醚化等反應。苯酚在通常溫度下是固體,與鈉不能順利發生反應,如果采用加熱熔化苯酚,再加入金屬鈉的方法進行實驗,苯酚易被氧化,在加熱時苯酚顔色發生變化而影響實驗效果。有人在教學中采取下面的方法實驗,操作簡單,取得了滿意的實驗效果。在一支試管中加入2-3毫升無水乙醚,取黃豆粒大小的一塊金屬鈉,用濾紙吸幹表面的煤油,放入乙醚中,可以看到鈉不與乙醚發生反應。然後再向試管中加入少量苯酚,振蕩,這時可觀察到鈉在試管中迅速反應,産生大量氣體。這一實驗的原理是苯酚溶解在乙醚中,使苯酚與鈉的反應得以順利進行。
酸堿反應
苯酚屬于酚類物質,有弱酸性,能與堿反應:
PhOH+NaOH→PhONa+H2O
苯酚Ka=1.28×10-10,酸性介于碳酸兩級電離之間,因此,苯酚不能與NaHCO3等弱堿反應:
PhOˉ+CO2+H2O→PhOH+HCO3ˉ
此反應現象:二氧化碳通入後,溶液中出現白色混濁。
原因:苯酚因溶解度小而析出。
顯色反應
苯酚遇三氯化鐵溶液顯紫色,原因是苯酚根離子與Fe形成了有顔色的配合物。
6PhOH+FeCl3→H3[Fe(OPh)6](紫色)+3HCl
取代反應
親電取代
苯酚由于結構中有苯環,可以在環上發生類似苯的親電取代反應,如硝化、鹵代等:對比苯的相應反應可以發現,苯酚環上的取代比苯容易得多。這是因為羟基有給電子效應,使苯環電子雲密度增加。
值得注意的是,苯酚的親電取代總是發生在羟基的鄰位和對位。這是羟基等給電子基團的共性。
酚羟基上的取代
酚羟基上的氫原子可以被含碳基團取代,生成醚或酯。
氧化還原
苯酚在空氣中久置會變為粉紅色,是因為生成了苯醌:
苯酚的氧化産物一般是對苯醌。這個反應也可以用Br2作氧化劑。
縮合反應
苯酚與甲醛在酸或堿的催化下發生縮合,生成酚醛樹脂。
計算化學數據
疏水參數計算參考值(XlogP):無
氫鍵供體數量:1
氫鍵受體數量:1
可旋轉化學鍵數量:0
互變異構體數量:2
拓撲分子極性表面積:20.2
重原子數量:7
表面電荷:0
複雜度:46.1
同位素原子數量:0
确定原子立構中心數量:0
不确定原子立構中心數量:0
确定化學鍵立構中心數量:0
不确定化學鍵立構中心數量:0
共價鍵單元數量:1
毒理學數據
1、急性毒性
LD50:317mg/kg(大鼠經口);270mg/kg(小鼠經口);669mg/kg(大鼠經皮);630mg/kg(兔經皮)
LC50:316mg/m3(大鼠吸入,4h)
2、刺激性
家兔經皮:500mg(24h),重度刺激。
家兔經眼:1mg,重度刺激。
3、亞急性與慢性毒性:動物長期吸入苯酚蒸氣(115.2~230.2mg/m3)可引起呼吸困難、肺損害、體重減輕和癱瘓。
4、緻突變性:DNA抑制:人Hela細胞1mmol/L。姐妹染色單體交換:人淋巴細胞5μmol/L。
5、緻畸性:雌性小鼠受孕後6~15d經口染毒2800mg/kg引發顱面部(包括鼻部和舌部)畸形,4g/kg引發肌肉骨骼系統發育畸形。
6、其他:大鼠經口最低中毒劑量(TDLo):1200mg/kg(孕6~15d),引起胚胎毒性。
生态學數據
1、生态毒性
LC50:49~36mg/L(48~96h)(黑頭呆魚);60~200mg/L(24h)(金魚,靜态);5.6~11mg/L(24h)(虹鳟魚,靜态);
EC50:56mg/L(96h)(水蚤);
IC50:4.6~7.5mg/L(72h)(藻類)
2、生物降解性
好氧生物降解:6~84h
厭氧生物降解:192~672h
3、非生物降解性
水相光解半衰期:46~173h
光解最大光吸收波長範圍:173~269nm
水中光氧化半衰期:77~3840h
空氣中光氧化半衰期:2.28~22.8h
4、生物富集性:BCF:1.7(金魚);20(金色圓腹雅羅魚);39(虹鳟魚)。
注意事項
健康危害
苯酚對皮膚、粘膜有強烈的腐蝕作用,可抑制中樞神經或損害肝、腎功能。
急性中毒:吸入高濃度蒸氣可緻頭痛、頭暈、乏力、視物模糊、肺水腫等。誤服引起消化道灼傷,出現燒灼痛,呼出氣帶酚味,嘔吐物或大便可帶血液,有胃腸穿孔的可能,可出現休克、肺水腫、肝或腎損害,出現急性腎功能衰竭,可死于呼吸衰竭。眼接觸可緻灼傷。可經灼傷皮膚吸收經一定潛伏期後引起急性腎功能衰竭。
慢性中毒:可引起頭痛、頭暈、咳嗽、食欲減退、惡心、嘔吐,嚴重者引起蛋白尿。可緻皮炎。
環境危害:對環境有嚴重危害,對水體和大氣可造成污染。
燃爆危險:該品可燃,高毒,具強腐蝕性,可緻人體灼傷。
急救措施
皮膚接觸:立即脫去污染的衣着,用甘油、聚乙烯乙二醇或聚乙烯乙二醇和酒精混合液 (7:3)抹洗,然後用水徹底清洗。或用大量流動清水沖洗至少15分鐘。就醫。
眼睛接觸:立即提起眼睑,用大量流動清水或生理鹽水徹底沖洗至少15分鐘。就醫。
吸入:迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸困難,給輸氧。如呼吸停止,立即進行人工呼吸。就醫。
食入:立即給飲植物油15~30mL。催吐。就醫。
消防措施
危險特性:遇明火、高熱可燃。
有害燃燒産物:一氧化碳、二氧化碳。
滅火方法:消防人員須佩戴防毒面具、穿全身消防服,在上風向滅火。
滅火劑:水、抗溶性泡沫、幹粉、二氧化碳。
洩漏應急處理
應急處理:隔離洩漏污染區,限制出入。切斷火源。建議應急處理人員戴防塵面具(全面罩),穿防毒服。
小量洩漏:用幹石灰、蘇打灰覆蓋。
大量洩漏:收集回收或運至廢物處理場所處置。
操作處置儲存
操作注意事項:密閉操作,提供充分的局部排風。盡可能采取隔離操作。操作人員必須經過專門培訓,嚴格遵守操作規程。建議操作人員佩戴自吸過濾式防塵口罩,戴化學安全防護眼鏡,穿透氣型防毒服,戴防化學品手套。遠離火種、熱源,工作場所嚴禁吸煙。使用防爆型的通風系統和設備。避免産生粉塵。避免與氧化劑、酸類、堿類接觸。搬運時要輕裝輕卸,防止包裝及容器損壞。配備相應品種和數量的消防器材及洩漏應急處理設備。倒空的容器可能殘留有害物。
儲存注意事項:儲存于陰涼、通風的庫房。遠離火種、熱源。避免光照。庫溫不超過30℃,相對濕度不超過70%。包裝密封。應與氧化劑、酸類、堿類、食用化學品分開存放,切忌混儲。配備相應品種和數量的消防器材。儲區應備有合适的材料收容洩漏物。應嚴格執行極毒物品“五雙”管理制度。
測定苯酚的酸性
實驗操作
1、在試管中取2mL苯酚溶液,滴加石蕊試劑,觀察現象。
2、在三支試管中分别取少量苯酚固體,并分别向其中加入2-3mL氫氧化鈉溶液、2-3mL碳酸鈉溶液、2-3mL碳酸氫鈉溶液,充分振蕩,觀察并比較現象(注意加鹽溶液的試管中是否有氣泡。)
3、在試管中取2mL氫氧化鈉溶液,滴加2-3滴酚酞試液,再加入少量苯酚固體,觀察顔色變化。
實驗現象
苯酚不能使石蕊變紅。
苯酚固體易溶于氫氧化鈉溶液和碳酸鈉溶液,無氣泡産生;難溶于碳酸氫鈉溶液。
苯酚使紅色溶液(滴有酚酞試液的氫氧化鈉溶液)逐漸變淺。
實驗結論
苯酚具有弱酸性,酸性介于碳酸和碳酸氫根離子之間。由于苯酚的酸性太弱,以至于不能使石蕊試劑變紅。(石蕊試液的變色範圍是:pH值5~8。)
在剛才制取的苯酚溶液中邊振蕩邊逐滴加入氫氧化鈉溶液,至恰好澄清,生成物為苯酚鈉。再持續通入二氧化碳氣體,溶液又變渾濁(二氧化碳與水生成碳酸,碳酸與苯酚鈉反應生成苯酚與碳酸氫鈉)。
綜上所述,根據強酸制弱酸的原理可知酸性: H2CO3 > NaHCO3 。亦可知碳酸的酸性比苯酚的酸性強。
應用領域
廣泛用于制造酚醛樹脂、環氧樹脂、錦綸纖維、增塑劑、顯影劑、防腐劑、殺蟲劑、殺菌劑、染料、醫藥、香料和炸藥等。
工業
苯酚是重要的有機化工原料,用它可制取酚醛樹脂、己内酰胺、雙酚A、水楊酸、苦味酸、五氯酚、2,4-D、己二酸、酚酞n-乙酰乙氧基苯胺等化工産品及中間體,在化工原料、烷基酚、合成纖維、塑料、合成橡膠、醫藥、農藥、香料、染料、塗料和煉油等工業中有着重要用途。此外,苯酚還可用作溶劑、實驗試劑和消毒劑,苯酚的水溶液可以使植物細胞内染色體上蛋白質與DNA分離,便于對DNA進行染色。
醫療
用法與用量
1、器械消毒及排洩物處理1%~5%水溶液。
2、皮膚殺菌與止癢:2%軟膏塗患處。
3、中耳炎用1%~2%苯酚甘油滴耳,每日3次。
制劑與規格
苯酚軟膏:2%。
苯酚甘油:①1%;②2%。
給藥說明
本品對組織穿透力強,僅在小面積皮膚上使用。高濃度外用可引起組織損傷,甚至壞死。水溶液用于體表,濃度不宜超過2%,外用後不加封包。
不良反應
本品對組織有腐蝕性和刺激性。曾報道在通風較差的場所,以苯酚消毒清潔搖籃和床墊等,引起新生兒高膽紅素血症,對嬰兒已證實有緻命性。
禁忌證
尿布皮炎患兒及6個月以下嬰兒禁用。避免應用在破損皮膚和傷口。