研究簡史
酒是古老的人造飲料,經考古發現,早在原始社會時期,人類就知道用谷物、瓜果發酵釀酒。中國是世界上最早釀酒的國家之一,甲骨文中就已經出現了“酒”字和與酒有關的“醴”“尊”“酉”等字。中國最晚在夏代已能人工造酒,《戰國策》中記載“帝女令儀狄造酒,進之于禹”。殷商時期,中國已擺脫原始釀酒的方法,開始進入制曲釀酒階段。周代釀酒已發展成獨立且具有相當規模的手工業作坊。最初的酒是果酒和米酒。夏之後,經商周、曆秦漢,以至于唐宋,都是以果實或糧食蒸煮,加曲發酵,經壓榨、過濾後制得的酒。随着人類的進步發展,釀酒工藝也在原來基礎上進一步發展,通過蒸餾提高了酒精的濃度,出現蒸餾酒。中國古人已發現酒在藥用方面的價值,《漢書·食貨志》中說:“酒,百藥之長。”《本草綱目》認為:“酒少飲則和血行氣,痛飲則傷神耗血,損胃之精,生痰動火。”
西方的酒品主要是谷物酒,長期沿用麥芽糖化加酵母的釀造法。直到19世紀90年代,法國人卡爾邁特從中國引進酒曲,從中分離出糖化力強并能起糖化作用的黴菌菌株,應用于酒精生産上,才突破了西方以麥芽糖化劑釀酒的傳統工藝。關于酒的藥用,19世紀醫學家用白蘭地治療心衰和傷寒等症,生理學家和藥理學家開始對酒精的藥理作用進行研究,發現酒精能影響鳥的中樞神經活動,抑制蛙和哺乳動物的心跳,影響狗的胃腸消化吸收功能。
人們對酒含有的主要成分——乙醇的認識也在逐步發展。1784年,法國化學家安托萬-洛朗·拉瓦錫(AntoineLaurent Lavoisier,1743—1794)首先測定了乙醇的元素成分。1807年,瑞士化學家尼古拉斯·泰奧多爾·索緒爾(Nicolas Theodore de Saussure,1767—1845)首先完成了乙醇的元素組成分析,确定了乙醇的化學式。1858年,英國化學家斯科特·庫珀(Archibald Scott Couper,1831—1892)提出了乙醇最初的結構式,即庫珀圖解式。1825年,英國化學家邁克爾·法拉第(Michael Faraday,1791—1867)首次以合成方式制備乙醇。
乙醇的工業化生産從19世紀末開始發展起來,到第二次世界大戰期間發酵法生産乙醇達到了高峰。發酵法是經典的乙醇生産方法,在相當長的時期裡是乙醇的主要來源。但是發酵法受到原料來源和成本高的限制,因此合成法逐漸興起。間接水合法制乙醇早在1825年就有報道,但直到1930年才由美國聯合碳化物公司實現工業化。由于間接水合法要消耗大量的濃硫酸,生産過程中的硫酸介質對設備有嚴重腐蝕而且産品分離提純困難,自1932年起美國和前蘇聯同時開始了直接水合法的研究。1945年,美國殼牌化學公司把磷酸吸附在顆粒狀矽藻土上,制備成固體催化劑,解決了直接水合法的催化劑問題。20世紀50年代末,原聯邦德國維巴化學公司在殼牌法基礎上改進了催化劑。到20世紀60年代,美國伊斯特曼-柯達公司又在水合工藝方面進行了改進。20世紀60年代後期,前蘇聯對水合催化劑進行了改進,最後确定為磷酸-矽藻土催化劑。乙醇的生産方法除發酵法和合成法外,合成氣制乙醇技術和甲醇同系化法也在開發中。
理化性質
物理性質
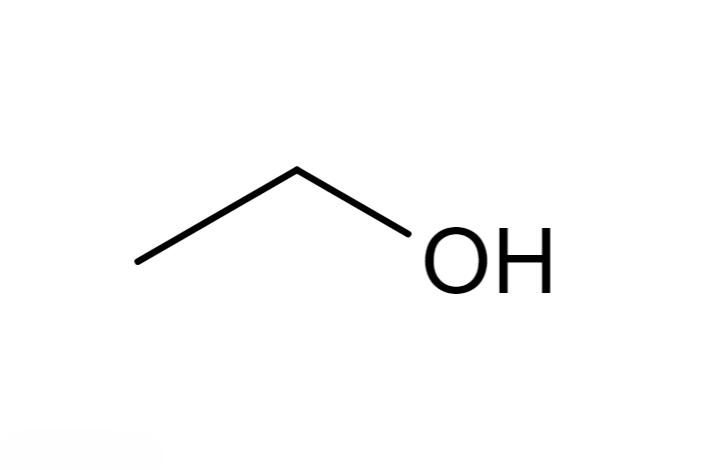
乙醇是帶有一個羟基的飽和一元醇,可以看成是乙烷分子中的一個氫原子被羟基取代的産物,或者是水分子中一個氫原子被乙基取代的産物。乙醇分子是由C、H、O三種原子構成的極性分子,其中C、O原子均以sp³雜化軌道成鍵。
乙醇在常溫常壓下是一種無色透明、易揮發、易燃燒、不導電的液體,它的水溶液具有酒香的氣味,味甘。在20 ℃常溫下,乙醇液體密度是0.7893 g/cm3。乙醇的熔點是-114.1 ℃,沸點是78.3 ℃。乙醇蒸氣能與空氣形成爆炸性混合物。20 ℃下,乙醇的折射率為1.3611。乙醇還是一種良好的溶劑,能與水以任意比互溶,可混溶于氯仿、乙醚、乙酸、甲醇、丙酮、甘油等多數有機溶劑。當乙醇與水混合時其體積減小,1體積的乙醇與1體積的水混合後其體積隻有1.92體積,而當乙醇與汽油混合時總體積則增大。
乙醇的物理性質主要與其低碳直鍊醇的性質有關。分子中的羟基可以形成氫鍵,因此乙醇具有潮解性,可以很快從空氣中吸收水分。分子間氫鍵的存在也使得乙醇的沸點高于相對分子質量相近的烷烴。乙醇分子中羟基的極性使得很多離子化合物可溶于乙醇中,如氫氧化鈉、氫氧化鉀、氯化鎂、氯化鈣、氯化铵、溴化铵和溴化鈉等;但氯化鈉和氯化鉀微溶于乙醇。非極性的烴基使得乙醇也可溶解一些非極性的物質,例如大多數香精油和很多增味劑、增色劑和醫藥試劑。乙醇還可與水、乙腈、苯、丁酮、丁醛、四氯化碳、氯仿、環己烷、1,2-二氯乙烷、乙酸乙酯、乙基丁基醚、己烷、乙酸異丙酯、異丙醚、乙酸甲酯、甲基環己烷、硝基甲烷、甲苯、三氯乙烯等形成二元共沸物,使得它們不能通過蒸餾的方法進行分離。
化學性質
乙醇的官能團是羟基(—OH),其化學性質主要由羟基和受它影響的相鄰基團決定,主要反應形式是О—H鍵和C—О鍵的斷裂。羟基的結構特征是氧的電負性很大,分子中的C—О鍵和O—H鍵都是極性鍵,因而乙醇分子中有2個反應中心。由于α-H和β-H受到C—О鍵極性的影響具有一定的活性,因此它們還能發生氧化反應和消除反應等。
1.酸堿性
乙醇具有弱酸性(嚴格來說不具有酸性,因為不能使酸堿指示劑變色),因含有極化的氧氫鍵,故電離時會生成烷氧基負離子和質子。其電離方程式為:
乙醇的pKa=15.9(25 ℃),與水相近,電離平衡足以使乙醇與重水之間迅速發生同位素交換。其化學反應式為:
2.與金屬反應
鉀、鈣、鈉等活潑金屬可将乙醇羟基裡的氫置換出來,生成醇鹽和氫氣,但不如和水反應劇烈。以乙醇與鈉的反應為例,産物乙醇鈉遇水可發生水解,生成乙醇和氫氧化鈉,因此乙醇鈉的水溶液呈強堿性。其化學反應式為:
3.氧化反應
乙醇的燃燒反應是廣義上的氧化反應。乙醇完全燃燒時發出淡藍色火焰,生成二氧化碳和水蒸氣,并放出大量的熱。其化學反應式為:
(點燃)
乙醇不完全燃燒時生成一氧化碳,有黃色火焰,放出熱量。其化學反應式為:
(點燃)
在有機化學中,氧化反應特指加氧或去氫的反應。乙醇可以發生脫氫反應,被氧化成為乙醛。其化學反應式為:
Cu/Ag
該反應可用于工業制乙醛。在人體内則可以通過乙醇脫氫酶(alcohol dehydrogenase,ADH)作用使乙醇變成乙醛。
乙醇也可被高錳酸鉀氧化成乙酸,同時高錳酸鉀由紫紅色變為無色。其化學反應式為:
乙醇也可與酸化的三氧化鉻溶液(或酸性重鉻酸鉀溶液)反應,當乙醇蒸氣進入含有酸化的三氧化鉻(或酸性重鉻酸鉀溶液)的矽膠中時,可見矽膠由黃色變成草綠色,該反應可用于檢驗司機是否飲酒駕車。其化學反應式為:
強氧化劑如高錳酸鉀及重鉻酸鉀都能将乙醇直接氧化成乙酸,反應不能停留在生成乙醛的階段。使用特殊的氧化劑,如Sarrett試劑,可使反應停留在乙醛的階段。Sarrett試劑是三氧化鉻與吡啶形成的配合物,溶于鹽酸後稱為氯鉻酸吡啶鹽(Pyridinium chlorochromate,PCC)。反應一般在二氯甲烷中進行。
CH2Cl2
4.酯化反應
乙醇與無機含氧酸(如硝酸、亞硝酸、硫酸和磷酸等)之間脫水,可生成相應的無機酸酯。以硝酸為例,其化學反應式為:
乙醇也可與有機含氧酸脫水生成有機酸酯。以乙酸為例,在濃硫酸催化并加熱的情況下,乙醇可與乙酸反應生成乙酸乙酯,其化學反應式為:
濃H2SO4
該反應可逆,在相同條件下,乙酸乙酯水解生成乙酸和乙醇的反應稱為乙酸乙酯的水解反應。為提高酯的産率,可适當增大反應物濃度或将生成的酯和水不斷蒸出反應體系,使平衡向右移動。
5.醇解反應
乙醇可與羧酸衍生物如酰鹵、酸酐、酯等發生醇解反應生成相應的酯,難易程度不同。
酰鹵活性很高,醇解反應進行較快。以乙酰氯為例,其化學反應式為:
酸酐的醇解比酰鹵緩和,反應中可用适量的酸或堿進行催化,是制備酯的常用方法。以乙酸酐為例,其化學反應式為:
堿
酯的醇解反應可逆,需要在酸或堿的催化下進行,反應中從一個酯生成另一個新的酯,所以該反應也叫做酯交換反應。以乙酸甲酯為例,其化學反應式為:
6.鹵化反應
乙醇可以和氫鹵酸發生取代反應,生成鹵代烴和水。其化學反應通式為:
反應活性順序:。鹽酸與乙醇的反應較困難,加無水氯化鋅可催化反應的進行。無水氯化鋅的濃鹽酸溶液稱為盧卡斯試劑(Lucas reagent)。乙醇可以溶解于盧卡斯試劑中,生成的氯乙烷則難溶,産生細小的油狀液滴分散在盧卡斯試劑中,使反應液變渾濁。
乙醇也可與鹵化磷(PX3、PX5)反應生成鹵代烴,該方法更為常用。其化學反應通式為:
乙醇與PX5的反應,因副産物磷酸酯比較多,産物分離較為困難,因此不是制備鹵代烴的好辦法。實際工作中,三鹵化磷常用鹵素單質與磷的反應産生:
乙醇還可與氯化亞砜反應生成氯乙烷,其化學反應式為:
用氯化亞砜作為鹵代試劑,副産物二氧化硫和氯化氫很容易離開反應體系,産物容易分離和純化。
7.脫水反應
乙醇在酸性條件下加熱可發生脫水反應。乙醇脫水可按兩種方式進行:一種是乙醇分子内脫一分子水生成烯烴(消除反應);另一種是兩個分子的乙醇發生分子間脫水生成乙醚(親核取代反應)。
乙醇在催化劑存在的條件下加熱,分子内消去一個水分子,生成乙烯。該反應屬于消除反應,其化學反應式為:
(濃)170℃
常用的催化劑還有磷酸、氧化鋁等。進行該反應時要在燒瓶中加入碎瓷片或沸石以免暴沸。
兩分子乙醇也可以發生分子間脫水而生成乙醚。其化學反應式為:
乙醇的消除反應和成醚反應都是在酸的作用下進行,二者是并存和相互競争的。較低的溫度下有利于成醚反應,而在高溫條件下有利于消除反應生成烯烴。若能控制好反應條件,可以使其中一種産物為主要産物。
由于分子間脫水成醚的副反應較多,一般較少用于醚的合成。更加常用的是Williamson合成法,即用醇鈉或酚鈉與鹵代烴反應,既可合成對稱醚,也可合成不對稱醚。以合成甲乙醚為例,其化學反應式為:
8.鹵仿反應
乙醛、甲基酮與次鹵酸鹽反應生成鹵仿和少一個碳的羧酸鹽的反應稱為鹵仿反應。由于乙醇在次鹵酸鹽條件下可氧化生成乙醛,故它也能發生鹵仿反應。乙醇與次氯酸鈉反應生成氯仿,溴仿和碘仿也可以分别由乙醇與次溴酸鈉和次碘酸鈉反應得到。在低碳醇中,隻有乙醇才能進行鹵仿反應。以乙醇與次碘酸鈉反應為例,其過程如下:
主要種類
1.按生産使用的原料可分為澱粉質原料發酵酒精、糖蜜原料發酵酒精、亞硫酸鹽紙漿廢液發酵生産酒精。
⑴澱粉質原料發酵酒精:一般有薯類、谷類和野生植物等含澱粉質的原料,在微生物作用下将澱粉水解為葡萄糖,再進一步由酵母發酵生成酒精;
⑵糖蜜原料發酵酒精:直接利用糖蜜中的糖分,經過稀釋殺菌并添加部分營養鹽,借酵母的作用發酵生成酒精;
⑶亞硫酸鹽紙漿廢液發酵生産酒精:利用造紙廢液中含有的六碳糖,在酵母作用下發酵成酒精,主要産品為工業用酒精,也有用木屑稀酸水解制作的酒精。
2.按生産的方法來分,可分為發酵法酒精和合成法酒精兩大類。
3.按産品質量或性質來分,又分為高純度酒精、無水酒精、普通酒精和變性酒精。
4.按産品系列分:GB 394-1981(已廢止)曾将酒精分為優級、一級、二級、三級和四級,其中一、二級相當于高純度酒精及普通精餾酒精,三級相當于醫藥酒精,四級相當于工業酒精。現行的GB/T 394.1-2008将工業酒精分為優級、一級、二級和粗酒精四類。現行的GB 10343-2008将食用酒精分為特級、優級和普通級三類。
制備方法
工業制備
工業上一般用發酵法、合成法和聯合生物加工法制取乙醇。
1.發酵法
發酵法是用澱粉原料(如谷類、薯類、玉米、高粱或野生植物果實)和糖質原料(如糖蜜、亞硫酸廢液)等發酵,前者是主要的發酵原料。發酵法是在釀酒基礎上發展起來的,在相當長的曆史時期内,曾是生産乙醇的唯一工業方法。在這個過程中,發生了一系列複雜的生化反應。以澱粉原料為例,整個生産過程包括原料蒸煮、糖化劑制備、糖化、酒母制備、發酵及蒸餾等工序。原料中的可溶性澱粉在酶的作用下水解為糖,再經過酵母菌發酵生成乙醇并放出二氧化碳(用糖質原料不需經過澱粉水解成葡萄糖這一步)。發酵液中乙醇的質量分數約為6%~10%,再經蒸餾工藝将乙醇濃縮為大約95.57%的酒精溶液。生産過程中的主要化學反應式為:
(酶)
(酵母菌)
2.合成法
随着近代有機工業的發展,可利用煉焦油、石油裂解所得的乙烯來合成乙醇。該法中的原料乙烯,可大量取自石油裂解氣,成本低,産量大,并且能大量節約糧食。化學合成法有直接水合法和間接水合法兩種,工業上普遍采用前者。
⑴直接水合法:乙烯與水蒸氣在有機磷催化劑存在的條件下,經高溫高壓作用,可直接發生加成反應生成酒精。該法步驟簡單,無腐蝕問題,但要求原料氣中乙烯純度在98%以上,需采用特殊的方法分離裂解其中的各種成分,對設備、材料都提出了較高要求。其化學反應式為:
(催化劑) (高溫高壓)
⑵間接水合法:又稱為硫酸水合法,是用硫酸與乙烯經加成作用生成硫酸氫乙酯,再進行水解,生成乙醇和硫酸。該法對原料氣體的純度要求不高,設備簡化。缺點是對設備腐蝕嚴重,酸消耗多。其化學反應式為:
(0℃-15℃)
(90℃)
3.聯合生物加工法
生物轉化使用的原料大多為糧食作物,大量使用會影響到糧食安全,而利用生物能源轉化技術生産乙醇,可緩解非再生化石能源日漸枯竭帶來的能源壓力。因稭稈、麸皮、鋸木粉等農業、工業廢棄物含有大量的木質纖維素,所以來源廣泛的纖維素是很有潛力的生産乙醇的原料。另外,在生物燃料的生産過程中,纖維素的預處理和纖維素酶的生産成本較高,故減少預處理,增強纖維素酶活性,提高發酵産物的産量和純度,減少中間環節也是降低生産成本的途徑。聯合生物加工不包括纖維素酶的生産和分離過程,而是把糖化和發酵結合到由微生物介導的一個反應體系中,因此與其他工藝過程相比較,底物和原料的消耗相對較低,一體化程度較高。這種綜合方法的未來發展前景廣闊。
此外,近年來有文獻報道了煤制乙醇的方法。煤制乙醇是以煤為原料經氣化為合成氣或者以工廠廢氣(主要成分均為一氧化碳和氫氣)為原料,生産乙醇。目前,以煤為源頭生産燃料乙醇的工藝路線主要包括四條,都需要首先将煤氣化為合成氣。從合成氣生産燃料乙醇主要有兩種方法,即直接法和間接法。直接法可由兩條工藝路線實現:合成氣化學催化路線和合成氣厭氧發酵路線。間接法制乙醇是先采用成熟的甲醇合成技術,将合成氣轉化為甲醇,然後再将甲醇羰基化為醋酸,最後再進行醋酸直接加氫或者将醋酸酯化後加氫生産乙醇。
實驗室制備
乙醇是常用的有機溶劑,在許多有機化學反應中,無論是作為反應物還是溶劑,乙醇的純度有時都對化學反應有着很大的影響。市售普通工業酒精是含95.6%乙醇和4.4%水的恒沸混合物,其沸點為78.15 ℃,用蒸餾的方法不能将乙醇中的水完全除去。若要得到含量較高的乙醇,可以把工業酒精與生石灰在一起進行加熱回流,使乙醇中的水分與氧化鈣充分反應,生成不揮發性的氫氧化鈣而除去。然後再采用蒸餾的方法把乙醇蒸出,這樣得到的乙醇的純度可達99.5%。其化學反應式為:
若要得到純度更高的無水乙醇,可用金屬鎂進行處理,也可用分子篩法進行制取。
應用領域
醫療用品
95%的酒精可用于擦拭紫外線燈。這種酒精在醫院常用,在家庭中則隻會将其用于相機鏡頭的清潔。
70%~75%的酒精可用于消毒。若酒精濃度過高,會在細菌表面形成一層保護膜,阻止其進入細菌體内,難以将細菌徹底殺死。若酒精濃度過低,雖可進入細菌,但不能将其體内的蛋白質凝固,同樣也不能将細菌徹底殺死。因此75%的酒精消毒效果最好。
40%~50%的酒精可用于預防褥瘡。長期卧床患者的背、腰、臀部因長期受壓可引發褥瘡,如按摩時将少許40%~50%的酒精倒入手中,均勻地按摩患者受壓部位,就能達到促進局部血液循環,防止褥瘡形成的目的。
25%~50%的酒精可用于物理退熱。高燒患者可用其擦身,達到降溫的目的。用酒精擦拭皮膚,能使患者的皮膚血管擴張,增加皮膚的散熱能力,酒精蒸發吸熱,使病人體表溫度降低,症狀緩解。
需要注意的是,酒精濃度不可過高,否則可能會刺激皮膚,并大量吸收表皮的水分。
食品飲料
乙醇是酒的主要成分,含量和酒的種類有關系。需要注意的是,飲用酒中的乙醇不是把乙醇加進去,而是微生物發酵得到的乙醇,根據使用微生物的種類不同還會有乙酸或糖等有關物質。
乙醇還可用于制造醋酸、飲料、焙烤食品、糖果、冰淇淋、沙司等。
有機原料
乙醇也是基本的有機化工原料,可用來制取乙醛、乙酸、乙醚、乙酸乙酯、乙胺等化工原料,也是制取溶劑、染料、塗料、香精、農藥、醫藥、橡膠、塑料、人造纖維、洗滌劑等産品的原料。
有機溶劑
乙醇可與水及多數有機溶劑混溶,被廣泛用作有機化學反應的溶劑及黏合劑、硝基噴漆、清漆、化妝品、油墨、脫漆劑等的溶劑。
乙醇也是液體制劑的常用溶劑,用于合劑、酊劑及注射劑中。乙醇的極性比水小,能溶解中藥中的中等極性、弱極性、非極性成分,如生物堿及其鹽類、苷類、揮發油、樹脂、鞣質、有機酸和親脂性色素等。中醫常用酒精泡制藥酒,送服中藥,以使藥物效果得到更大的發揮;也利用其防腐作用,用作存放和保管物品。
由于葉綠體中的色素能溶在無水乙醇中,所以生物學上常用無水乙醇提取葉綠體中的色素。
汽車燃料
乙醇可單獨作為汽車燃料,也可與汽油混合作為混合燃料。在汽油中添加5%~20%燃料乙醇制成乙醇汽油,可減少汽車尾氣對空氣的污染。另外,乙醇還可以作為抗爆劑添加到汽油中以代替四乙基鉛
計算化學數據
1.疏水參數計算參考值(XlogP):-0.1
2.氫鍵供體數量:1
3.氫鍵受體數量:1
4.可旋轉化學鍵數量:0
5.互變異構體數量:0
6.拓撲分子極性表面積:20.2 Ų
7.重原子數量:3
8.表面電荷:0
9.複雜度:2.8
10.同位素原子數量:0
11.确定原子立構中心數量:0
12.不确定原子立構中心數量:0
13.确定化學鍵立構中心數量:0
14.不确定化學鍵立構中心數量:0
15.共價鍵單元數量:1
安全措施
環境危害
危險性:易揮發,易燃燒,刺激性。其蒸氣與空氣混合成爆炸性氣體。遇到高熱、明火能燃燒或爆炸,與氧化劑鉻酸、次氯酸鈣、過氧化氫、硝酸、硝酸銀、過氯酸鹽等反應劇烈,有發生燃燒爆炸的危險。在火場中,受熱的容器有爆炸危險。其蒸氣比空氣重,能在較低處擴散到相當遠的地方,遇明火會引着回燃。
健康危害
侵入途徑:吸入、食入、經皮吸收。
健康危害:本品為中樞神經系統抑制劑。首先引起興奮,随後抑制。
急性中毒:急性中毒多發生于口服。一般可分為興奮、催眠、麻醉、窒息四個階段。患者進入第三或第四階段,出現意識喪失、瞳孔擴大、呼吸不規律、休克、心力循環衰竭及呼吸停止。
慢性影響:在生産中長期接觸高濃度乙醇可引起鼻、眼、黏膜刺激症狀以及頭痛、頭暈、疲乏、易激動、震顫、惡心等。長期酗酒可引起多發性神經病、慢性胃炎、脂肪肝、肝硬化、心肌損害及器質性精神病等。皮膚長期接觸可引起幹燥、脫屑、皲裂和皮炎。
環境标準
乙醇的環境标準如下:
危害防治
工程控制:密閉操作,加強通風。
呼吸系統防護:一般不需要特殊防護,高濃度接觸時可佩帶過濾式防毒面具(半面罩)。
眼睛防護:戴化學安全防護眼鏡。
身體防護:穿防靜電的膠布防毒衣。
手防護:戴一般作業防護手套(橡膠手套)。
其他防護:工作完畢,淋浴更衣。保持良好的衛生習慣。
應急處置
洩漏:迅速撤離洩漏污染區人員至安全區,并進行隔離,嚴格限制出入。切斷火源。建議應急處理人員戴自給正壓式呼吸器,穿消防防護服。盡可能切斷洩漏源,防止進入下水道、排洪溝等限制性空間。
小量洩漏:用砂土或其它不燃材料吸附或吸收。也可用大量水沖洗,洗水稀釋後放入廢水系統。
大量洩漏:構築圍堤或挖坑收容;用泡沫覆蓋,降低蒸氣災害。用防爆泵轉移至槽車或專用收集器内,回收或運至廢物處理場所處置。
滅火方法:抗溶性泡沫、幹粉、二氧化碳、水霧。
毒理資料
毒性:微毒。
急性毒性:LD50 7060 mg/kg(兔經口);LD50 7340 mg/kg(兔經皮);LC50 37620 mg/m³,10 h(大鼠吸入);人吸入4.3 mg/L,50 min,頭面部發熱,四肢發涼,頭痛;人吸入2.6 mg/L,39 min,頭痛,無後作用。
刺激性:家兔經眼,500 mg,重度刺激。家兔經皮開放性刺激試驗:15 mg/24 h,輕度刺激。
亞急性和慢性毒性:大鼠經口 10.2 g/(kg·d)、12周:體重下降,脂肪肝。
緻突變性:(微生物緻突變)鼠傷寒沙門氏菌陰性。
顯性緻死試驗:小鼠經口1~1.5 g/(kg·d),2周,陽性。
生殖毒性:大鼠腹腔最低中毒濃度(TDL0):7.5 g/kg(孕9天),緻畸陽性。
緻癌性:小鼠經口最低中毒劑量(TDL0):340 mg/kg(57周,間斷),緻癌陽性。
儲存運輸
儲存方法
存儲于陰涼、通風的庫房。遠離火種、熱源。庫溫不宜超過30℃。保持容器密封。應與氧化劑、酸類、堿金屬、胺類等分開存放,切忌混儲。采用防爆型照明、通風設施。禁止使用易産生火花的機械設備和工具。儲區應備有洩漏應急處理設備和合适的收容材料。
運輸信息
危險貨物編号:32061
UN編号:1170
包裝标志:7(易燃液體)
包裝類别:O52
包裝方法:小開口鋼桶;小開口鋁桶;螺紋口玻璃瓶、鐵蓋壓口玻璃瓶、塑料瓶或金屬桶(罐)外木闆箱。螺紋口玻璃瓶、塑料瓶或鍍錫薄鋼闆桶(罐)外滿底闆花格箱、纖維闆箱或膠合闆箱。
運輸注意事項:鐵路運輸時應嚴格按照鐵道部《危險貨物運輸規則》中的危險貨物配裝表進行配裝。本品運輸時限使用鋼制企業自備罐車裝運,運裝前需報有關部門批準。運輸時運輸車輛應配備相應品種和數量的消防器材及洩漏應急處理設備。夏天最好早晚運輸。運輸時所使用的的槽(罐)車應有接地鍊,槽内可設孔隔闆以減少震蕩産生靜電。應單獨運輸,嚴禁與酸類、易燃物、有機物、氧化劑、自燃物品、遇濕易燃物品等并車混運。運輸途中應防暴曬、雨淋、防高溫。中途停留時應遠離火種、熱源、高溫區。裝運該物品的車輛排氣管必須配備阻火裝置,禁止使用易産生火花的機械設備和工具裝卸。公路運輸時要按照規定路線行駛,勿在居民區和人口稠密區停留。鐵路運輸時要禁止溜放。嚴禁用木船、水泥船散裝運輸。
檢測方法
乙醇含量的測定有物理方法和化學方法。物理方法有氣相色譜法、密度瓶法、酒精計法、折射計測定法。化學方法有重鉻酸鉀比色法、莫爾鹽法、碘量滴定法。
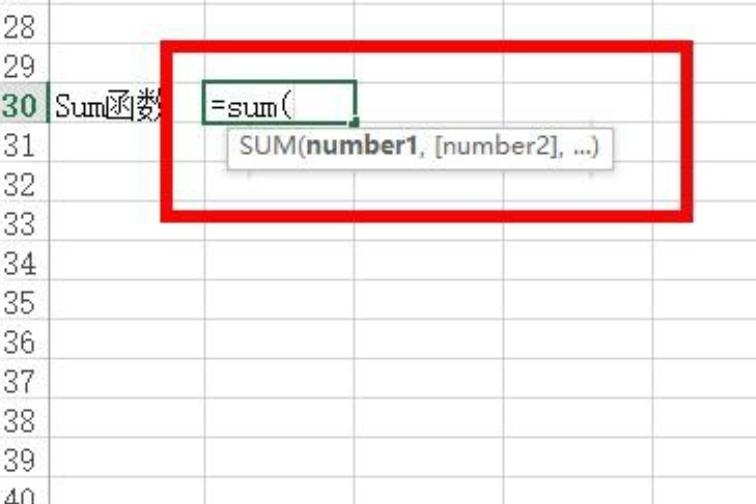
1.氣相色譜法
樣品在氣相色譜儀中通過色譜柱時,由于在氣固兩相中吸附系數不同,而使乙醇與其他組分分離,利用氫火焰離子化檢測器進行鑒定,用内标法定量。
标準溶液配制:用5個10.00 mL容量瓶分别準确量取10.00 mL不同濃度的乙醇标準溶液,再分别加入0.50 mL内标溶液,混勻。該溶液用于标準曲線的繪制。
試樣制備:吸取10.00 mL樣品于10.00 mL容量瓶中,準确加入0.50 mL内标溶液,混勻。
通過試驗選擇最佳色譜條件進樣,使乙醇和内标物完全分離。分别吸取0.3 μL乙醇标準溶液,快速從進樣口注入色譜儀,同時開啟記錄儀記錄譜圖。以标樣峰面積和内标峰面積比值對乙醇濃度作标準曲線。用試樣組分峰面積與内标峰面積的比值查标準曲線得出的值,乘以稀釋倍數,即為試樣中的乙醇含量。
2.密度瓶法
以蒸餾法去除樣品中的不揮發性物質,用密度瓶法測定餾出液的密度。根據餾出液的密度,求得20 ℃時乙醇的體積百分數,即酒精度。
試樣制備:20 ℃時準确量取一定量的樣品于蒸餾瓶中,用水沖洗容量瓶,洗液并入蒸餾瓶中,連接冷凝器,以取樣用的原容量瓶作接收器(外加冰浴),緩慢加熱蒸餾。收集餾出液接近刻度,取下容量瓶,蓋塞。在20 ℃水浴中保溫30 min,補加水至刻度,混勻備用。
蒸餾水質量測定:将附溫度計的密度瓶洗淨烘幹至恒重m。然後取下溫度計,用煮沸冷卻至15 ℃左右的蒸餾水注滿密度瓶,插上帶溫度計的瓶塞,排除氣泡。浸入20.0±0.1 ℃的恒溫水浴中,待溫度達20℃,并保持10 min不變後,用濾紙吸去側管溢出的液體,使側管中的液面與側管管口齊平,立即蓋好側孔罩,取出密度瓶,用濾紙擦幹瓶壁上的水,稱量m1。
試樣質量測定:将密度瓶中的水倒出,洗淨并使之幹燥,然後裝滿制備好的試樣,按上述步驟操作,稱量m2。
餾出液20 ℃時相對密度 的計算式為:
式中:m為密度瓶的質量(g),m1為密度瓶和水的質量(g),m2為密度瓶和餾出液的質量(g)。根據餾出液的相對密度,查乙醇水溶液的相對密度與乙醇濃度換算表,得出試樣乙醇含量。
3.酒精計法
以蒸餾法去除樣品中的不揮發性物質,用酒精度表直接讀取溫度和酒精的示值,加以溫度校正,求得20 ℃時乙醇的體積百分數,即酒精度。
将量筒中餾出液攪拌均勻,靜置,排除氣泡,輕輕放入洗淨、擦幹的酒精計,再略按一下,靜置後,水平觀測與彎月面相切處的刻度示值。同時測量溫度,換算成20 ℃時乙醇的體積百分數。
4.浸入式折射計測定法
取除氣樣品,經過濾,用浸入式折射計測出20 ℃的折光率。乙醇含量A(g/100 g樣品)可按下列公式計算:
式中:r0為浸入式折射計20℃時的讀數減去14.5(20 ℃純水在浸入式折射計中的讀數),,d為用比重瓶法測定的樣品比重。
5.重鉻酸鉀比色法
重鉻酸鉀能将乙醇氧化為乙酸,同時6價鉻被還原為3價鉻,可用比色法進行測定。化學反應式如下:
标準系列管配制:在10mL比色管中加入各溶液,如下表所示:
各管中加1 mL 2%重鉻酸鉀溶液,5 mL濃硫酸,搖勻。在沸水浴中加熱10 min,取出冷卻。
試樣制備:稱取100 g樣品,置于500 mL圓底燒瓶中,加200 mL水,蒸餾,用100 mL容量瓶正确接收流出液100 mL,搖勻。吸取5 mL餾出液,置于10 mL比色管中,加1 mL 2%重鉻酸鉀溶液,5 mL濃硫酸,搖勻。與标準系列管一起在沸水浴中加熱10 min,取出冷卻。
分光光度法測光密度:在600 nm下測定光密度,繪制标準曲線,得出回歸方程。根據回歸方程計算5 mL餾出液的乙醇含量。最後換算出100 g樣品中的乙醇含量。
6.莫爾鹽法
在酸性溶液中,乙醇被重鉻酸鉀氧化生成乙酸,過量的重鉻酸鉀溶液與莫爾鹽(FeSO4·(NH4)2SO4·6H2O)作用,然後以赤血鹽(K3Fe(CN)6)作外指示劑,與過量的莫爾鹽起顯色反應。
吸取10 mL試樣于三角瓶中,瓶口裝有玻璃彎管,插入盛有5 mL重鉻酸鉀溶液和2.5 mL濃硫酸的試管底部,将試管放入冷水中。當液體被蒸出2/3時停止蒸餾。将玻璃管取出,試管中液體倒入250 mL燒杯中,并用水洗淨試管和玻璃管插入部分,然後用莫爾鹽溶液滴定,不斷攪拌,由黃色滴定至鮮綠色為止。同時用赤血鹽作外指示劑進行斑點試驗,即被滴定的溶液由黃逐漸變綠時,每滴定0.1~0.2 mL莫爾鹽溶液,就要取一滴試樣在白瓷闆上觀察顔色,斑點為淺藍色即為終點(同時按上述方法用蒸餾水代替試樣進行空白試驗)。
試樣中的乙醇含量可按下式計算:
乙醇(%)
式中:5為重鉻酸鉀溶液的體積,V1為空白試驗消耗莫爾鹽溶液體積,V2為滴定試樣消耗莫爾鹽溶液的體積,0.0126為與1 mL重鉻酸鉀溶液相當的乙醇體積;10為吸取試樣的體積。
7.碘量滴定法
在酸性溶液中,乙醇被重鉻酸鉀氧化生成乙酸,過量的重鉻酸鉀溶液以碘化鉀還原,析出的碘,以硫代硫酸鈉溶液滴定。
取50 mL試樣放入250 mL三角瓶中,加50 mL水,迅速蒸餾出50 mL備用。在兩個250 mL碘量瓶中,各吸取10 mL 0.1 N重鉻酸鉀和5 mL濃硫酸,混勻冷卻至室溫。在一瓶中加入5 mL餾出液,另一瓶中加入5 mL水(空白試驗)。混勻靜置2 min,使乙醇完全氧化,然後分别加入4%碘化鉀溶液10 mL,搖勻,置暗處5 min,再各加入約150 mL水,立即用0.1 N硫代硫酸鈉滴定,當滴定至微黃綠色時,加入1%澱粉指示劑1 mL,繼續滴定至呈現淡青綠色為終點。
試樣中的乙醇含量可按下式計算:
乙醇(%)
式中:V1為空白試驗消耗0.1 N硫代硫酸鈉體積,V2為滴定餾出液消耗0.1 N硫代硫酸鈉體積,0.00146為與1 mL 0.1 N硫代硫酸鈉相當的乙醇體積,V為吸取餾出液的體積,F為0.1 N硫代硫酸鈉的當量濃度校正系數。
相關法規
《工作場所安全使用化學品規定》([1996] 勞部發423号)等法規,針對化學危險品的安全使用、生産、儲存、運輸、裝卸等方面均作了相應規定。《常用危險化學品的分類及标志》(GB13690-1992)将該物質劃為第3.2類中閃點易燃液體。乙醇[無水]被列入《危險化學品目錄(2015版)》。
衍生物
⑴乙醛:乙醇氧化或氣相脫氫生産乙醛曾是工業乙醇的主要用途。乙醛在工業上大量用于合成乙酸、丁醇、季戊四醇等有機産品,也用于生産聚乙醛、三氯乙醛等産品。
⑵乙胺:乙胺是由乙醇與氨經催化反應生成的,同時得到乙胺、二乙胺和三乙胺。乙胺、二乙胺可作溶劑,也可用來制造洗滌劑、潤滑劑和橡膠促進劑、農藥、染料、醫藥以及抗氧劑等。三乙胺除用作有機溶劑外,在合成樹脂中可用作聚碳酸酯光氣法的催化劑和四氟乙烯的阻聚劑,也可用作食品防腐劑、農藥和染料生産的原料,國防工業上可用作高能燃料。
⑶乙醚:乙醚是由乙醇用硫酸脫水制得的,也是直接法生産乙醇的副産品。在間接水合法生産乙醇時,硫酸二乙酯和乙醇反應也可得到乙醚。乙醚是有機化合物的優良溶劑,對許多物質如生物堿、油類、樹脂、香料等具有良好的溶解性能,而乙醚與乙醇的混合物又是硝化纖維的溶劑。
⑷乙酸乙酯:由乙酸和乙醇酯化得到,是纖維素酯的低沸點溶劑,可用作人造革、火藥、食品工業中的食用香精、纖維照像膜片及醫藥和染料等方面的原料。