簡介
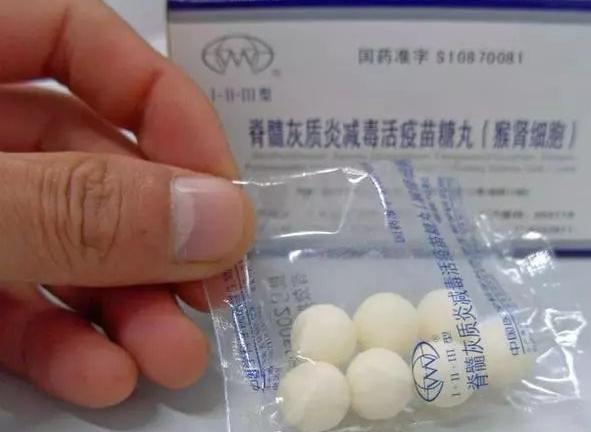
脊髓灰質炎減毒活疫苗糖丸(人二倍體細胞)
拼音名:JisuihuizhiyanJianduHuoyimiaoTangwan(RenErbeitiXibao)
英文名:PoIiomyeIitisVaccineinDrageeCandy(HumanDiploidCeII),LiVe
本品系用脊髓灰質炎病毒I、Ⅱ、lII型減毒株分别接種于人二倍體細胞,經培養、收獲後制成糖丸。用于預防脊髓灰質炎。
生産和檢定用設施、原料及輔料、水、器具、動物等應符合“凡例”有關要求。
疫苗制造
2.1生産用細胞
生産用細胞為人二倍體細胞。
2.1.1細胞庫管理及檢定應符合“生物制品生産用動物細胞基質制備及檢定規程”規定。
取自同批工作細胞庫的1支或多支細胞管,經複蘇擴增後的細胞僅用于一批疫苗的生産。
主細胞庫細胞世代應控制在第23代以内,工作細胞庫細胞世代應控制在第27代以内,生産用細胞世代應控制在第44代以内。
2.1.2細胞制備
從工作細胞庫之細胞種子開始培養,連續傳代,至足夠數量的細胞培養物。長成單層的細胞用0.25%胰蛋白酶消化,分散均勻後以适宜的分種率傳代,于37℃貼壁靜置或旋轉培養。
2.2毒種
2.2.1名稱及來源
生産用毒種為脊髓灰質炎病毒I、Ⅱ、Ⅲ型減毒株;可用I、Ⅱ、111型Sabin株,l、Ⅱ、Ⅲ型Sabin純化株,中Ⅲ2株或經批準的其他毒株。
2.2.2種子批的建立
應符合“生物制品生産檢定用菌毒種管理規程”規定。
2.2.2.1原始種子批
Sabin株原始毒種I、Ⅱ、Ⅲ型及中Ⅲ2株均由毒種研制者制備和保存。
2.2.2.2主種子批
由原始毒種在胎猴腎或人二倍體細胞上傳1~2代制成的成分均一的一批病毒懸液稱為主種子批。
Sabin株主種子批的傳代水平為SO十1;中Ⅲ2株主種子批的傳代水平為中Ⅲ21代;Ⅲ型pfizer株主種子批為RSO1。
2.2.2.3工作種子批
取主種子批毒種在人二倍體細胞上傳l~2代制備的組成均一的一批病毒懸液稱為工作種子批。
2.2.3毒種傳代
從原始種子批到工作種子批的傳代次數,SabinI型、SabinⅡ型和其他純化株以及中Ⅲ2株不得超過3代;sabinⅢ型及其他純化株包括pfizer株不得超過2代。制備生産用種子批所用的細胞應限于眙猴腎或人二倍體細胞。
2.2.4種子批毒種的檢定
除另有規定外,主種子批及工作種子批應進行以下全面檢定。
2.2.4.1鑒别試驗
取适量I型、Ⅱ型或Ⅲ型單價脊髓灰質炎病毒抗血清與适量病毒供試品混合,置35~37℃中和1~2小時,接種Hep-2細胞或其他敏感細胞,置适宜溫度(35~36℃)培養,7天判定結果,病毒型别應準确無誤。同時設血清和細胞對照,均應為陰性。病毒對照應為陽性。
2.2.4.2病毒滴定
采用微量細胞病變法。取毒種做10倍系列稀釋,每稀釋度病毒液接種Hep-2細胞或其他敏感細胞,置适宜溫度(35~36℃)培養,7天判定結果。病毒滴度應不低于6.5lgCCID〈[50]〉/ml。應同時進行病毒參考品滴定。
2.2.4.3無菌檢查
依法檢查(附錄ⅫA),應符合規定。
2.2.4.支原體檢查
依法檢查(附錄ⅫB),應符合規定。
2.2.4.5病毒外源因子檢查
依法檢查(附錄ⅫC),應符合規定。
2.2.4.6家兔檢查
取毒種進行此項檢查。如不立即進行試驗,毒種應保存于-20℃以下。取體重為1.5~2.5kg的健康家兔至少5隻,每隻注射10ml,其中1.0ml皮内多處注射,其餘皮下注射,觀察3周,到期存活動物數應不低于80%,無B病毒和其他病毒感染判為合格。家兔在24小時以後死亡,疑有B病毒感染者應屍檢.須留神經組織和髒器标本待查,用腦組織做10%懸液,用同樣方法接種5隻健康家兔進行檢查。
2.2.4.7免疫原性檢查
用工作種子批毒種制成原疫苗,按常規接種易感兒童(免前抗體效價<1:4)至少30名,分别于免疫前及免疫後4周采血,測定中和抗體,免疫後抗體陽轉率應不低于95%。
2.2.4.8猴體神經毒力試驗
依法檢查(附錄ⅪL),應符合規定。
2.2.4.9rct特征試驗
将單價病毒液分别于360℃±0.1℃及400℃±0.1℃進行病毒滴定,試驗設t-對照(生産毒種或已知對人安全的疫苗)。如果病毒液和t-對照在36℃±O.1℃的病毒滴度與40℃±0.1℃的滴度差不低于5.01g,則rct特征試驗合格。
2.2.4.10SV40核酸序列檢查
依法檢查(附錄IXH),應為陰性。
2.2.5毒種保存
液體毒種需加入終濃度為lmol/L的氯化鎂溶液,置-60℃以下保存。
2.3原液
2.3.1細胞制備
同2.1.2項。
2.3.2培養液
細胞的培養液為含适量滅能小牛血清和乳蛋白水解物的MEM液或其他适宜培養液。小牛血清的質量應符合要求(附錄ⅧD)。病毒維持液為不含小牛血清的MEM液或其他适宜維持液。
2.3.3對照細胞病毒外源因子檢查
依法檢查(附錄ⅫC),應符合規定。
2.3.4病毒接種和培養
毒種與細胞按一定比例接種。種毒後置33℃±0.5℃培養40~96小時至細胞出現完全病變後收獲。
2.3.5病毒收獲
病毒液逐瓶澄清過濾,收集于大瓶中,即為單價原液。
2.3.6原液合并或濃縮
原液可合并或濃縮。
2.3.7原液檢定
按3.1項進行。
2.4半成品
2.4.1配制
單價原液加入氯化鎂,其終濃度為1mol/L,即為單價疫苗半成品。取适量I、Ⅱ、Ⅲ型單價疫苗半成品,按一定比例進行配制,即為三價疫苗半成品。
2.4.2半成品檢定
按3.2項進行。
2.5成品
2.5.1疫苗糖丸制備
三價疫苗半成品及賦形劑按一定比例混合後制成糖丸。滾制糖丸時,操作室内溫度應在18℃以下。
2.5.2分批
應符合“生物制品分批規程”規定。同一次混合的三價疫苗半成品制備的糖丸為一批,非同容器滾制的糖丸分為不同亞批。
2.5.3分裝
應符合“生物制品分裝和凍幹規程”規定。
2.5.4規格
每粒1g。每1次人用劑量1粒,含脊髓灰質炎活病毒總量應不低于5.95lg
CCID〈[50]〉,其中I型應不低于5.81gCCID〈[50]〉,Ⅱ型應不低于4.8Ig
CCID〈[50]〉,Ⅲ型應不低于5.3lgCCID〈[50]〉。
2.5.5包裝
應符合“生物制品包裝規程”規定。
疫苗檢定
3.1原液檢定
3.1.1鑒别試驗
按2.2.4.1項進行。
3.1.2病毒滴定
按2.2.4.2項進行,病毒滴度應不低于6.51gCCID〈[50]〉/ml。
3.1.3猴體神經毒力試驗
依法檢查(附錄XlL),應符合規定。
3.1.4無菌檢查
依法檢查(附錄ⅫA),應符合規定。
3.1.5支原體檢查
依法檢查(附錄ⅫB),應符合規定。
3.2半成品檢定
3.2.1病毒滴定
按2.2.4.2項進行。三價疫曲病毒滴度應不低于7.15lgCCID〈[50]〉/ml,其中I型應不低于7.01gCCID〈[50]〉/m1,Ⅱ型應不低于6.OlgCCID〈[50]〉/m1,Ⅲ型應不低于6.5lgCCID〈[50]〉/m1。
3.2.2無菌檢查
依法檢查(附錄ⅫA),應符合規定。
3.3成品檢定
每個亞批取200~300粒。
3.3.1鑒别試驗
取适量I、Ⅱ、Ⅲ型三價混合脊髓灰質炎病毒抗血清與适量本品混合,置35~37℃中和1~2小時,接種Hep-2細胞或其他敏感細胞,置适宜溫度(35~36℃)培養,7天判定結果,應無病變出現。同時設血清和細胞對照,均應為陰性。病毒對照應為陽性。
3.3.2外觀
應為白色固體糖丸。
3.3.3丸重差異
取糖丸20粒測定,每1粒重量為lg±0.15g。
3.3.4病毒滴定
每3~4亞批合并為1個檢定批,取100粒糖丸,加Earle’s液至1000ml,即為1:10稀釋度,取适宜的稀釋度用病變法進行病毒滴定。
三價疫苗糖丸以混合法測定病毒含量,同時應以中和法檢測各型病毒含量。采用中和法需預先精确測定異型抗體的交叉抑制值,以校正滴定結果。按2.2.4.2項測定病毒滴度,每劑三價疫苗糖丸病毒總量應不低于5.95lgCCID〈[50]〉,其中I型應不低于5.81gCCID〈[50]〉,Ⅱ型應不低于4.8lgCCID〈[50]〉,Ⅲ型應不低于5.3lgCCID〈[50]〉。
3.3.5熱穩定性試驗
疫苗出廠前應進行熱穩定性試驗,應與病毒滴定同時進行。37℃放置48小時後,按2.2.4.2項進行病毒滴定,病毒滴度應不低于5.0lgCCID〈[50]〉,病毒滴度下降應不高于1.0lg。
3.3.6病毒分布均勻度
每批抽查糖丸l0粒以上,測定疫苗糖丸的病毒分布均勻度。逐粒滴定病毒含量,各粒之間的病毒含量差不得超過0.51g。
3.3.7雜菌數檢查
同一天滾制的糖丸為1個供試品,每個糖丸滾制容器中取樣不得少于10粒,每粒雜菌數不得超過300個。
3.3.8緻病菌檢查
不得含有乙型溶血性鍊球菌、腸道緻病菌或大腸杆菌。
3.3.8.1乙型溶血性鍊球菌檢查
取經l0倍稀釋的本品0.5ml,接種肉湯培養基1支,置37℃培養24小時,再用劃線法移種血平皿1個,37℃培養24小時,應無乙型溶血性鍊球菌生長(如原料、輔料已做過此項檢查并合格,成品可不再做)。
3.3.8.2腸道緻病菌檢查
取經10倍稀釋的本品1.0ml,接種GN或肉湯增菌培養基1管,置37℃培養,于6~24小時内用劃線法轉種鑒别培養基平皿1個,37℃培養24小時,如有革蘭陰性杆菌,應進一步鑒定是否為腸道緻病菌。
3.3.8.3大腸杆菌檢查
取經10倍稀釋的本品,接種普通克斯列或麥康凱肉湯培養基3管,每管2ml,置37℃培養48小時,不應有産酸、産氣現象。如有産酸、産氣現象,應進一步鑒别是否為大腸杆菌。
疫苗成品
【别名】
小兒麻痹症活疫苗糖丸,脊髓灰質炎活疫苗、口服脊髓灰質炎減毒活疫苗
英文名:PoliomyelitisVaccine,Live(Oral)
漢語拼音:koufu jisuihuizhiyan jianduhuoyimiao
【規格】
本品劑型為糖丸,每人用劑量為1g重糖丸1粒,所含活病毒總量為5.95LgTCID50(或PFU),其中Ⅰ型為5.8LgTCID50(或PFU)、Ⅱ型為4.8LgTCID50(或PFU)、Ⅲ型為5.3LgTCID50(或PFU)。
【質量标準】
本品依據《中國生物制品規程》2000年版标準生産和檢定,符合質量要求。
【作用與用途】
本疫苗口服免疫後,可刺激機體産生抗脊髓灰質炎病毒免疫力,用于預防脊髓灰質炎。
【作用】:服用脊灰疫苗,是預防脊髓灰質炎發生的特異性免疫措施。
【疫苗簡介】:目前我國使用的脊灰疫苗是減毒活疫苗,是混合糖丸疫苗。糖丸疫苗需用奶粉、奶油、葡萄糖等材料作輔劑,将液體疫苗滾入糖中,即糖丸疫苗。糖丸疫苗為白色,對熱非常敏感。屬于國家免疫規劃的第一類疫苗。
【接種對象與免疫程序】:出生滿2個月開始服糖丸,每次服1粒,連服3次,每次間隔≥28天,4歲複服一次。其他年齡組在需要時也可以服用。
【服用方法】:基礎免疫為3次,首次免疫從2月齡開始,連續口服3次,每次間隔4-6周。4歲再加強免疫1次,每1次人用劑量1粒。其他年齡組在需要時也可以服用。
【儲存與運輸】:脊灰疫苗對熱敏感,低溫條件下比較穩定,應在-20℃~8℃的條件下運輸和避光保存。
【禁忌症】:一般無特殊禁忌症。燒、患急性傳染病、免疫缺陷症、接受免疫抑制劑治療者及孕婦忌服;對發熱、急性疾病、慢性疾病活動期和重度腹瀉的兒童應緩用;對牛奶過敏者應慎用。
【服苗反應】:該疫苗比較安全,無嚴重的不良反應。個别兒童服苗後1~2天内出現發熱、惡心、嘔吐、腹瀉等,偶爾有皮疹,2~3天内不需要治療可自愈。症狀重者可對症治療。
【服苗時注意事項】:(1)本品隻供口服,不能注射。
(2)本品系活疫苗,切勿加在熱開水或熱的食物内服用。服食前後30分鐘内不能喝、吃熱飲料熱食。
【免疫效果】:經多年的實踐證明,脊灰疫苗的免疫效果是非常明顯的,在控制和消滅脊灰工作中起到十分重要的作用。
【保存、運輸及使用期限】
自疫苗糖丸檢定合格之日起,-20℃以下保存有效期為2年,4~8℃保存有效期為5個月。運輸應在冷藏條件下進行。在盒簽标明的有效期内使用。
【劑型】診斷試劑
【貯藏】在2~8℃的暗處保存
【規格】1ml(10人份)
【批準文号】國藥準字S20003029
【生産企業】中國醫學科學院醫學生物學研究所