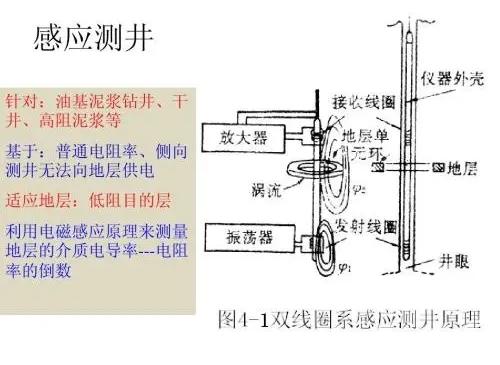
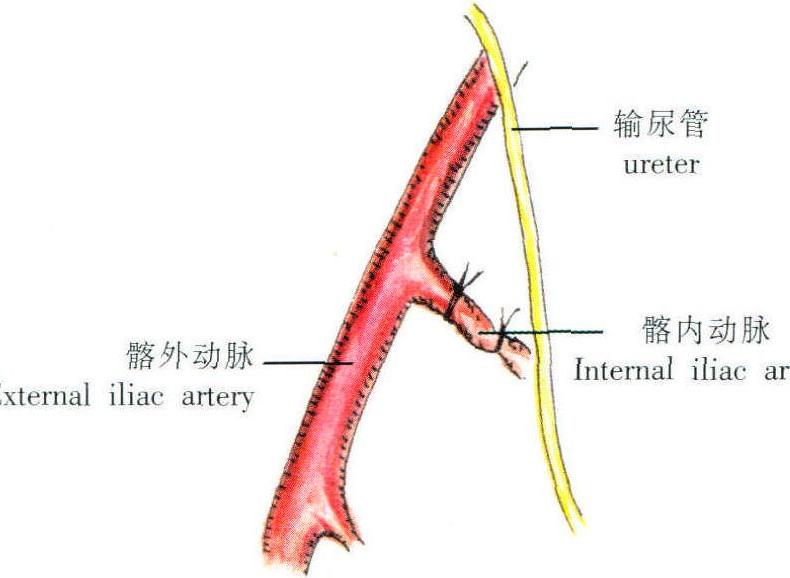
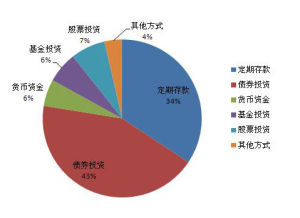
基本介紹
時間是化學動力學的一個重要變量。經典的化學動力學實驗方法不能制備單一量子态的反應物,也不能檢測由單次反應碰撞所産生的初生态産物。體系的熱力學平衡性質不能給出化學動力學的信息,全面認識一個化學反應過程并付諸實現,不能缺少化學動力學研究。
量子化學的計算至今還不能得到反應體系的可靠的、完整的勢能面。因此,現行的反應速率理論仍不得不借用經典統計力學的處理方法。這樣的處理必須作出某種形式的平衡假設,因而使這些速率理論不适用于非常快的反應。盡管對于衡假設的适用性研究已經很多,但完全用非平衡态理論處理反應速率問題尚不成熟。
分子束(即分子散射),特别是交叉分子束方法對研究化學元反應動力學的應用,使在實驗上研究單次反應碰撞成為可能。分子束實驗已經獲得了許多經典化學動力學無法取得的關于化學元反應的微觀信息,分子反應動力學是現代化學動力學的一個前沿陣地。
體系的熱力學平衡性質不能給出化學動力學的信息。例如,對以下反應:2H2(氣)+O2(氣)→2H2O(氣)盡管H2、O2和H2O的所有熱力學性質都已準确知道,但隻能預言H2和O2生成H2O的可能性,而不能預言H2和O2在給定的條件下能以什麼樣的反應速率生成H2O,也不能提供 H2分子和O2分子是通過哪些步驟結合為H2O分子的信息。所以,全面認識一個化學反應過程并付諸實現,不能缺少化學動力學研究。
研究曆史
20世紀前半葉,大量的研究工作都是對這些參數的測定、理論分析以及利用參數來研究反應機理。但是,反應機理的确認主要依賴于檢出和分析反應中間物的能力。20世紀後期,自由基鍊式反應動力學研究的普遍開展,給化學動力學帶來兩個發展趨向:一是對元反應動力學的廣泛研究;二是迫切要求建立檢測活性中間物的方法,這個要求和電子學、激光技術的發展促進了快速反應動力學的發展。對暫态活性中間物檢測的時間分辨率已從20世紀50年代的毫秒級提高到皮秒級。
研究對象
化學動力學是研究化學反應速率(rate of reaction)和反應機理(mechanism of reaction)的化學分支學科。化學動力學的主要内容包括以下幾點:
1)确定化學反應的速率以及溫度、壓力、催化劑、溶劑和光照等外界因素對反應速率的影響;
2)研究化學反應機理,揭示化學反應速率本質;
3)探求物質結構與反應能力之間的關系和規律。
研究意義
通過化學動力學的研究,可以知道如何控制反應條件,提高主反應的速率,增加産品産量,抑制副反應的速率,減少原料消耗,減少副産物,提高純度,提高産品質量。化學動力學也研究如何避免危險品的爆炸、材料的腐蝕、産品的變質與老化等問題。所以化學動力學的研究有理論與實踐上的重大意義。
研究方法
化學動力學的研究方法有:
①唯象動力學研究方法,也稱經典化學動力學研究方法,它是從化學動力學的原始實驗數據——濃度c與時間t的關系——出發,經過分析獲得某些反應動力學參數——反應速率常數k、活化能Ea、指前因子A。用這些參數可以表征反應體系的速率特征,常用的關系式有:式中r為反應速率;A、B、C、D為各物質的濃度;α、β、γ、δ稱為相對于物質A、B、C、D的級數;R為氣體常數;T為熱力學溫度。
化學動力學參數是探讨反應機理的有效數據,對暫态活性中間物檢測的時間分辨率已從20世紀50年代的毫秒級變為皮秒級。
②分子反應動力學研究方法,從微觀的分子水平來看,一個元化學反應是具有一定量子态的反應物分子間的互相碰撞,進行原子重排,産生一定量子态的産物分子以至互相分離的單次反應碰撞行為。用過渡态理論解釋,它是在反應體系的超勢能面上一個代表體系的質點越過反應勢壘的一次行為。原則上,如果能從量子化學理論計算出反應體系的正确的勢能面,并應用力學定律計算具有代表性的點在其上的運動軌迹,就能計算反應速率和化學動力學的參數。但是,除了少數很簡單的化學反應以外,量子化學的計算至今還不能得到反應體系的可靠的完整的勢能面。因此,現行的反應速率理論(如雙分子反應碰撞理論、過渡态理論)仍不得不借用經典統計力學的處理方法。這樣的處理必須作出某種形式的平衡假設,因而使這些速率理論不适用于非常快的反應。盡管對平衡假設的适用性研究已經很多,但完全用非平衡态理論處理反應速率問題尚不成熟。在20世紀60年代,對化學反應進行分子水平的實驗研究還難以做到。它應用現代物理化學的先進分析方法,在原子、分子的層次上研究不同狀态下和不同分子體系中單分子的基元化學反應的動态結構,反應過程和反應機理。它從分子的微觀層次出發研究基元反應過程的速率和機理,着重于從分子的内部運動和分子因碰撞而引起的相互作用來觀察化學基元過程的動态學行為。中科院大連化學物理研究所分子反應動力學國家重點實驗室在這方面研究有突出的貢獻。
③網絡動力學研究方法,它對包括幾十個甚至上百個元反應步驟的重要化工反應過程(如烴類熱裂解)進行計算機模拟和優化,以便進行反應器最佳設計的研究。
區别
化學動力學是研究化學過程進行的速率和反應機理的物理化學分支學科。
化學動力學與化學熱力學不同,不是計算達到反應平衡時反應進行的程度或轉化率,而是從一種動态的角度觀察化學反應,研究反應系統轉變所需要的時間,以及這之中涉及的微觀過程。化學動力學與熱力學的基礎是統計力學、量子力學和分子運動論。
它的研究對象是性質随時間而變化的非平衡的動态體系。化學熱力學是物理化學和熱力學的一個分支學科,它主要研究物質系統在各種條件下的物理和化學變化中所伴随着的能量變化,從而對化學反應的方向和進行的程度作出準确的判斷。化學熱力學是建立在三個基本定律基礎上發展起來的。熱力學第一定律就是能量守恒和轉化定律,它是許多科學家實驗總結出來的。
動力學是理論力學的分支學科,研究作用于物體的力與物體運動的關系。動力學的研究對象是運動速度遠小于光速的宏觀物體。原子和亞原子粒子的動力學研究屬于量子力學;可以比拟光速的高速運動的研究則屬于相對論力學。動力學是物理學和天文學的基礎,也是許多工程學科的基礎。許多數學上的進展常與解決動力學問題有關,所以數學家對動力學有濃厚的興趣。
用途
利用化學動力學原理可以:
(1)研究藥物降解的機理;
(2)研究影響藥物降解的因素及穩定化措施;
(3)預測藥物制劑的有效期。
主要概念
反應速率
反應速率是化學反應快慢程度的量度,廣義地講是參與反應的物質的量随時間的變化量的絕對值,分為平均速率與瞬時速率兩種。平均速率是反應進程中某時間間隔(Δt)内參與反應的物質的量的變化量,可用單位時間内反應物的減少量或生成物的增加量來表示;瞬時速率是濃度随時間的變化率,即濃度-時間圖像上函數在某一特定時間的切線斜率。
反應平衡
反應平衡:熱力學研究反應達到反應平衡時的狀态。在可逆反應中,反應物與産物達到動态平衡,正向反應與逆向反應的速率相等,反應物與産物的濃度不再發生變化。它可通過哈伯法合成氨、化學振蕩反應如Belousov-Zhabotinsky反應(B-Z反應)、碘鐘反應等多組分反應過程來進行演示。
反應機理
反應機理:雖然化學方程式中各物質的計量比看似簡單,但微觀上,一個化學反應通常是經過幾步完成的,描述化學反應的微觀過程的化學動力學分支稱為反應機理。反應機理中,每一步反應稱作基元反應,基元反應中反應物的分子數總和稱為反應分子數。反應機理由一個或多個基元反應所組成,這些基元反應的淨反應即為表觀上的化學反應。