産生由來
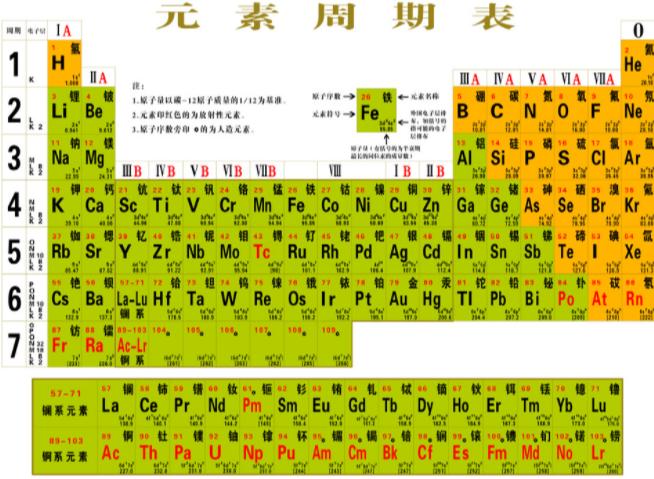
現代化學的元素周期律是1869年俄國科學家門捷列夫(Dmitri Mendeleev)首創的,他将當時已知的63種元素依相對原子質量大小并以表的形式排列,把有相似化學性質的元素放在同一列,制成元素周期表的雛形。經過多年修訂後才成為當代的周期表。在周期表中,元素是以元素的原子序排列,最小的排行最先。表中一橫行稱為一個周期,一列稱為一個族。
原子半徑由左到右依次減小,上到下依次增大。
在化學教科書中,都附有一張“元素周期表(英文:the periodic table)”。這張表揭示了物質世界的秘密,把一些看來似乎互不相關的元素統一起來,組成了一個完整的自然體系。
它的發明,是近代化學史上的一個創舉,對于促進化學的發展,起了巨大的作用。看
到這張表,人們便會想到它的最早發明者——門捷列夫。1869年,俄國化學家門捷列夫按照相對原子質量由小到大排列,将化學性質相似的元素放在同一縱行,編制出第一張元素周期表。
元素周期表揭示了化學元素之間的内在聯系,使其構成了一個完整的體系,成為化學發展史上的重要裡程碑之一。随着科學的發展,元素周期表中未知元素留下的空位先後被填滿。
當原子結構的奧秘被發現時,編排依據由相對原子質量改為原子的質子數﹙核外電子數或核電荷數﹚,形成現行的元素周期表。
原子序數
按照元素在周期表中的順序給元素編号,得到原子序數。原子序數跟元素的原子結構有如下關系:
質子數=原子序數=核外電子數=核電荷數
預測性
利用周期表,門捷列夫成功的預測當時尚未發現的元素的特性(镓、钪、鍺)。1913年英國科學家莫色勒利用陰極射線撞擊金屬産生X射線,發現原子序越大,X射線的頻率就越高,因此他認為核的正電荷決定了元素的化學性質,并把元素依照核内正電荷(即質子數或原子序)排列。後來又經過多名科學家多年的修訂才形成當代的周期表。
門捷列夫總結的化學元素周期表含有63種化學元素豎列稱為主族或者副族、橫列稱為周期、後經完善現已經發展成為111種元素
,并将化學性質相似的元素放在一個縱列。每一種元素都有一個序号,大小恰好等于該元素原子的核内質子數,這個序号稱為原子序數。在周期表中,元素是以元素的原子序排列,最小的排行最前。
排序方式
原子的核外電子排布和性質有明顯的規律性,科學家們是按原子序數遞增排列,将電子層數相同的元素放在同一行,将最外層電子數相同的元素放在同一列。
元素周期表中每一個橫行叫作一個周期,每一個縱行叫作一個族(8、9、10縱行為一個族)。這7個周期又可分成短周期(1、2、3)、長周期(4、5、6)和不完全周期(7)。共有16個族,又分為7個主族(ⅠAⅡA ⅢA ⅣA ⅤA ⅥA ⅦA), 7個副族(ⅠB ⅡB ⅢB ⅣB ⅤB ⅥB ⅦB),ⅧB族(包括三個縱行),一個零族。
元素在周期表中的位置不僅反映了元素的原子結構,也顯示了元素性質的遞變規律和元素之間的内在聯系。使其構成了一個完整的體系稱為化學發展的重要裡程碑之一。
同一周期内,從左到右,元素核外電子層數相同,最外層電子數依次遞增,原子半徑遞減(零族元素除外)。失電子能力逐漸減弱,獲電子能力逐漸增強,金屬性逐漸減弱,非金屬性逐漸增強。元素的最高正氧化數從左到右遞增(沒有正價的除外)。
意義
元素周期表的意義重大,科學家正是用此來尋找新型元素及化合物。
很多人注意到,元素周期表最後幾位元素永遠是以ium結尾的,其實這隻是一種臨時命名規則,叫IUPAC元素系統命名法。在這種命名法中,會為未發現元素和已發現但尚未正式命名的元素取一個臨時西方文字名稱并規定一個代用元素符号,使用拉丁文數字頭以該元素之原子序來命名。此規則簡單易懂且使用方便,而且它解決了對新發現元素搶先命名的惡性競争問題,使為新元素的命名有了依據。如ununbium便是由un(一)- un(一)- bi(二)- ium(元素)四個字根組合而成,表示“元素112号”。而ununtrium便是由un(一)- un(一)- tri(三)- ium(元素)四個字根組合而成,表示“元素113号”。
功能
原子半徑
(1)除第1周期外,其他周期元素(惰性氣體元素除外)的原子半徑随原子序數的遞增而減小;
(2)同一族的元素從上到下,随電子層數增多,原子半徑增大。
元素化合價
(1)除第1周期外,同周期從左到右,第二周期元素最高正價由堿金屬+1遞增到氮元素+5(氟無正價,氧無+6價),其他周期元素最高正價由堿金屬+1遞增到+7,非金屬元素負價都由碳族-4遞增到-1。
(2)同一主族的元素的最高正價、負價均相同。
單質的熔點
(1)同一周期元素随原子序數的遞增,元素組成的金屬單質的熔點遞增,非金屬單質的熔點遞減;
(2)同一族元素從上到下,元素組成的金屬單質的熔點遞減,非金屬單質的熔點遞增。
元素的金屬性
(1)同一周期的元素從左到右金屬性遞減,非金屬性遞增;
(2)同一主族元素從上到下金屬性遞增,非金屬性遞減。
水化物酸堿性
元素的金屬性越強,其最高價氧化物的水化物的堿性越強;元素的非金屬性越強,最高價氧化物的水化物的酸性越強。(F/Cl;O/S除外)
非金屬氣态
元素非金屬性越強,氣态氫化物越穩定。同周期非金屬元素的非金屬性越強,其氣态氫化物水溶液一般酸性越強;同主族非金屬元素的非金屬性越強,其氣态氫化物水溶液的酸性越弱。
單質的氧化
一般元素的金屬性越強,其單質的還原性越強,其氧化物的氧離子氧化性越弱;元素的非金屬性越強,其單質的氧化性越強,其單原子陰離子的還原性越弱。
元素位置推斷
1、元素周期數等于核外電子層數;
2、主族元素的序數等于最外層電子數;
3、确定族數應先确定是主族還是副族,其方法是采用原子序數逐步減去各周期的元素種數,即可由最後的差數來确定。最後的差數就是族序數,差為8、9、10時為VIII族,差數大于10時,則再減去10,最後結果為族序數。
根據各周期所含的元素種類推斷,用原子序數減去各周期所含的元素種數,當結果為“0”時,為零族;當為正數時,為周期表中從左向右數的縱行,如為“2”則為周期表中從左向右數的第二縱行,即第ⅡA族;當為負數時其主族序數為8+結果。所以應熟記各周期元素的種數,即2、8、8、18、18、32、32、1(目前)。