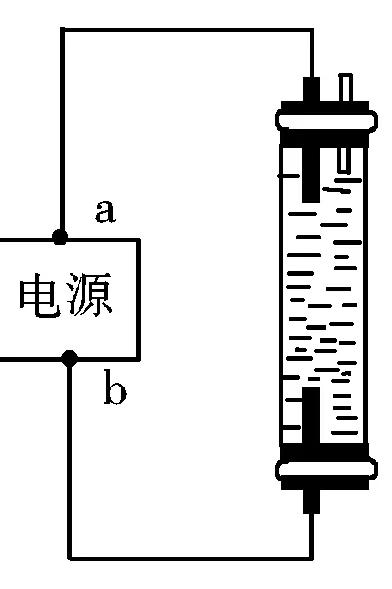
原理
在食鹽水裡氯化鈉完全電離,水分子是微弱電離的,因而存在着Na+、H+、Cl-、OH-四種離子。即:
NaCl= Na++Cl-
H2O⇌ H++OH-(可逆)
在電場的作用下,帶負電的OH-和Cl-移向陽極,帶正電的Na+和H+移向陰極。
在陽極,Cl-比OH-容易失去電子被氧化成氯原子,氯原子兩兩結合成氯分子放出氯氣。即:
2Cl--2e=Cl2↑(氧化反應)
在陰極,H+比Na+容易得到電子,因而H+不斷從陰極獲得電子被還原為氫原子,氫原子兩兩結合成氫分子從陰極放出氫氣。即:
2H++2e=H2↑ (還原反應)
H在陰極上不斷得到電子而生成氫氣放出,破壞了附近的水的電離平衡,因而水分子大量電離成H和OH,且生成OH的快慢遠大于其向陽極定向運動的速率。因此,陰極附近的OH大量增加,使溶液中産生氫氧化鈉:
OH-+ Na+= NaOH
所以電解飽和食鹽水的總的化學方程式可以表示如下:
2NaCl+2H2O=通電=2NaOH+H2↑+Cl2↑
工業用途
工業上利用2NaCl+2H₂O===通電===2NaOH+H₂↑ +Cl₂↑,制取燒堿、氯氣和氫氣。(燒堿即為氫氧化鈉)氯氣和氫氣反應:H₂+Cl₂===點燃或光照===2HCl,生成的HCl氣體溶于水便是鹽酸。
氯氣與氫氧化鈉溶液反應:2NaOH+Cl2=NaCl+NaClO+H2O,生成的NaClO有很強的氧化性,次氯酸的鹽類(如:次氯酸鈣)可以作漂白劑與殺毒劑。
在上面的電解飽和食鹽水的實驗中,電解産物之間能夠發生化學反應,如NaOH溶液和Cl2或Cl離子接觸會生成NaClO與NaCl,H₂和Cl₂混合遇火或光照能發生爆炸。在工業生産中,要避免這幾種産物混合,常使反應在特殊構造的、帶有離子交換膜(不允許帶負電的氯離子或氯氣通過)的電解槽中進行。
實驗研究
實驗強調電解飽和食鹽水,既加快反應速率,同時也因為氯氣在飽和食鹽水中的溶解量較小。