簡介
酸性
酸性是指由“H+”表現出的性質。
說明:
(1)酸性和酸不同,酸具有酸性,但具有酸性的不一定是酸。
(2)一些鹽自身雖然不含“H+”,但在水溶液中通過和水的作用也能産生部分“H+”,也能顯現出酸性。例如:NH4Cl溶液(在NH4Cl溶液中加入鎂條可以産生氫氣。
堿性
堿性是指由“OH-”表現出的性質。
說明:
(1)堿性和堿不同,堿具有堿性,但具有堿性的不一定是堿。
(2)一些鹽自身雖然不含“OH-”,但在水溶液中通過和水的作用也能産生部分“OH-”,也能顯現出堿性。例如:CH3COONa溶液。
定義
酸堿性在曆史上的不同階段,有着不同的定義,其中一些早已被淘汰,另一些則一直沿用下來。一般的來說,酸堿性指的是使酸堿指示劑變色的性質,但并不是所有的酸堿都能使酸堿指示劑變色,這就需要對其進行準确的定義。
布朗斯特酸堿
布朗斯特與勞倫認為,酸是質子的給予體,堿是質子的接受體,并且酸堿存在共轭關系。因此,酸性是物質能提供質子給堿的性質,堿性是物質能接受酸提供的質子的性質。同樣地,在此理論中我們可以定量地描述酸堿的強弱。另外,雖然一些物質仍不符合該理論的酸堿定義,但仍可擁有酸性 / 堿性,例如純淨的三氧化硫并不能給出質子,但卻具有較強的酸性。
路易斯酸堿
路易斯認為,酸是電子的接受體,堿是電子的給予體。該理論可以诠釋絕大部分物質的酸堿性的來源,實用性極其廣泛,但是并不能給出酸堿性強弱的定量關系,甚至有時酸堿性會無法比較。例如三氟化硼與三氯化硼均是較強的路易斯酸,但在一些酸堿反應中,三氟化硼體現出的酸性比三氯化硼強,而在另一些情況中,三氯化硼的酸性卻比三氟化硼強。具體的比較酸堿性強弱,是路易斯酸堿理論的一大難點,後來提出的HSAB一定程度上彌補了這個缺陷。
強弱标度
在阿倫尼烏斯酸堿理論中,酸堿性的強弱可以通過水溶液中的氫離子與氫氧根離子濃度進行定量比較(這裡的濃度準确來講是活度,但稀溶液中氫離子濃度與活度接近,可用易于獲得數據的濃度代替活度),氫離子濃度表示為c(H+),氫氧根濃度表示為c(OH-),氫離子濃度越大酸性越強,氫氧根離子濃度越大堿性越強。同溫度下,水溶液中c(H+)·c(OH-)是定值,由此可見酸性越強的溶液堿性越弱,堿性越強的溶液酸性越弱。
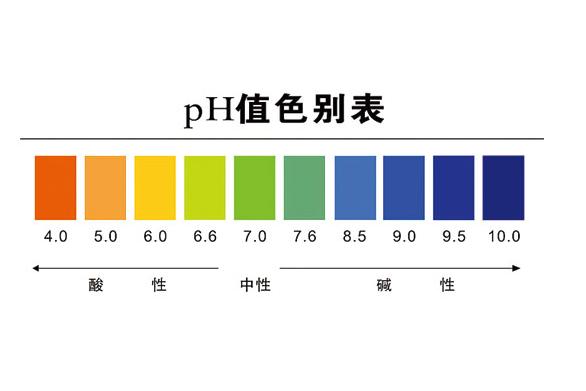
1909年丹麥的一位化學家提出用pH來表示酸堿性的強弱,pH是氫離子濃度的負對數,即:pH=-log[H+],同理pOH是氫氧根離子濃度的負對數。
引入pH的一大好處是簡便了書寫,并且方便比較溶液的酸堿性強弱。298K時,水溶液中c(H+)·c(OH-)是定值10-14,所以pH+pOH=14。pH<7的溶液呈酸性,pH=7的溶液呈中性,pH>7的溶液呈堿性。
溶液酸性、中性或堿性的判斷依據是:c(H+)和c(OH-)的相對大小.在任意溫度時溶液c(H+)>c(OH-)時呈酸性,c(H+)=c(OH-)時呈中性,c(H+)
在标準溫度(25℃)和壓強下,pH=7的水溶液(如:純水)為中性,這是因為水在标準壓強和溫度下自然電離出的氫離子和氫氧根離子濃度的乘積(水的離子積常數)始終是1×10^(-14),且兩種離子的濃度都是1×10^(-7)mol/L。pH小說明H+的濃度大于OH-的濃度,故溶液酸性強,而pH大則說明H+的濃度小于OH-的濃度,故溶液堿性強。所以pH越小,溶液的酸性越強;pH越大,溶液的堿性也就越強。
通常pH是一個介于0和14之間的數,當pH<7的時候,溶液呈酸性,當pH>7的時候,溶液呈堿性,當pH=7的時候,溶液呈中性.但在非水溶液或非标準溫度和壓力的條件下,pH=7可能并不代表溶液呈中性,這需要通過計算該溶劑在這種條件下的電離常數來決定pH為中性的值。如373K(100℃)的溫度下,pH=6為中性溶液。
測試
測酸堿性可以用石蕊試液和酚酞,石蕊試液遇中性不變色,遇酸性變紅,遇堿性變藍;酚酞遇中性、酸性均不變色,遇堿性變成紅色。
測量酸堿性的較精确方法是pH試紙,酸度計與中和滴定。其中pH試紙的精确度較差,一般隻有一位,或沒有有效數字,酸度計的精确度可達2~3位有效數字,滴定則可以達到小數點後兩位。
随着科學的進步,還可以使用ph計來測量酸堿度,并且采用pH計能更好地控制化學反應,達到提高生産率和産品質量以及安全生産的目的。帶有自動記錄的pH測量系統還可對污染公害提供訴訟的證據。某些間歇生産過程(例如某些化肥生産、食品加工過程)采用pH計後可變為連續生産方式。在現代工業中采用pH計比其他類型的連續分析儀表的總和還多。幾乎凡需用水的生産部門都需要采用pH計。其應用範圍從工業用水和廢物處理到采礦中的浮選過程,包括紙漿和造紙、金屬加工、化工、石油、合成橡膠生産、發電廠、制藥、食品加工等廣泛領域。