理論基礎
玻爾理論是指一種關于原子結構的理論。理論基礎是普朗克的量子論和愛因斯坦的光子學說。1900年,普朗克在研究黑體輻射問題時,提出了著名的量子化理論。該理論指出,物質吸收和發射能量是不連續的。也就是說,物質吸收和發射能量,就像物質微粒一樣,隻能以單個的、一定分量的能量,一份一份地或按照這一基本分量的倍數吸收或發射能量,即能量是量子化的。這種能量的最小單位叫能量子,簡稱量子。
1905年,愛因斯坦(A.Einstein)引用普朗克的量子論并加以推廣,用于解釋光電效應,提出了光子學說。當能量以光的形式傳播時,其最小單位是光量子(簡稱光子),實驗證明,光子的能量與光的頻率成正比。能量及其他物理量的不連續性是微觀世界的重要特征。
基本假設
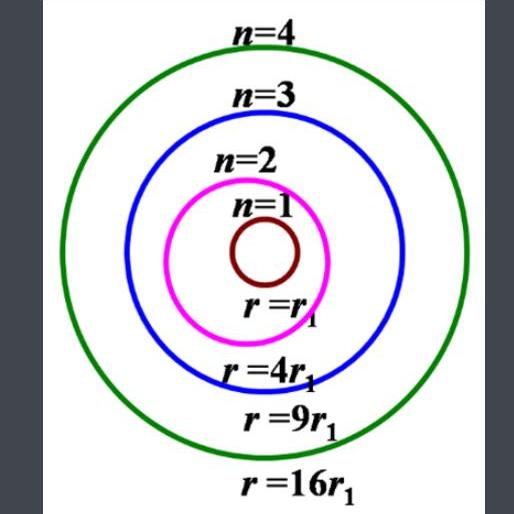
玻爾在氫原子和類氫原子(即原子核核外隻有一個電子的,如、等)的光譜以及普朗克的量子論、愛因斯坦的光子學說的基礎上,提出了原子結構理論的幾點假設。n核外電子隻能在某些特定的(有确定的半徑和能量)圓形軌道上繞核運動,電子在這些符合量子化條件的軌道上運動時,處于穩定狀态,這些軌道的能量狀态不随時間而改變,因而被稱為定态軌道。在定态軌道上運動的電子既不吸收能量,也不放出能量。n電子在不同軌道上運動時,其能量是不同的。軌道離核愈遠,能量愈高。當原子中的電子處于離核最近的軌道時,它們處于最低的能量狀态,稱為基态。當原子從外界獲得能量時,電子可以躍遷到離核較遠、能量較髙的軌道上,這種狀态稱為激發态。電子的能S量是量子化的,它不可能處于兩個允許的相鄰軌道的能量之間。n電子在能量不同的軌道之間躍遷時,原子才會吸收或放出能量。處于激發态的電子不穩定,可以躍遷到離核較近的軌道上,同時釋放出光能。
意義與局限性
玻爾理論同波爾輝煌的人生一樣,對二十世紀物理學的發展有深遠的影響。
玻爾理論不但回答了氫原子穩定存在的原因,而且還成功地解釋了氫原子和類氫原子的光譜現象。氫原子在正常狀态時,核外電子處于能量最低的基态,在該狀态下運動的電子既不吸收能量,也不放出能量,電子的能量不會減少,因而不會落到原子核上,原子不會毀滅。當氫原子從外界獲得能量時,電子就會躍遷到能盤較高的激發态,處于激發态的電子不穩定,就會自發地躍遷回能量較低的軌道,同時将能量以光的形式發射出來。由于兩個軌道即兩個能級間的能量差是确定的,且軌道的能量是不連續的,所以發射出光的頻率有确定值,而且是不連續的,因此得到的氫原子光譜是線狀光譜。
玻爾的原子模型卻無法說明多電子原子的光譜,甚至不能說明氫原子光譜的精細結構。也就是說,玻爾理論雖然引用了普朗克的量子化概念,卻沒有跳出經典力學的範圍。而電子的運動并不遵循經典物理學的力學定律,而是具有微觀粒子所特有的規律性——波粒二象性,這種特殊的規律性是玻爾在當時還沒有認識到的。