简介
热休克蛋白(HSPs)是广泛存在于生物界从原核到真核细胞中的一类具有高度保守性的蛋白质,当细胞在受到某些不利因素(如高热、感染、缺血、缺氧及化学物质等)刺激时,会迅速短暂地大量合成,并通过与细胞内部分变性的蛋白质结合,协助其复性或将其运送至溶酶体降解而发挥细胞保护功能,因而可以认为应激时HSPs在细胞内的出现标志着细胞自身保护机制的启动。
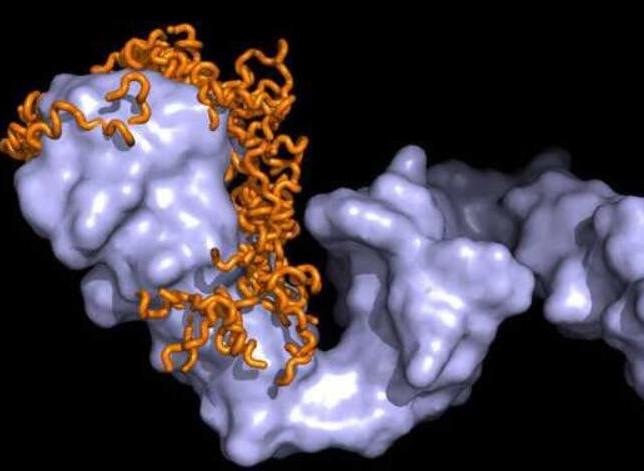
热休克蛋白依据其分子质量而命名。例如,Hsp60、Hsp70与Hsp90(被研究最多的热休克蛋白)指的是热休克蛋白家族的质量分别大约为60、70与90千道尔顿。另有一种8千道尔顿的蛋白泛素,这种蛋白用于标记即将分解的蛋白质,也表现出热休克蛋白的性质。
产生
热休克蛋白是一种在能对细胞产生损伤的在多种外在刺激下产生的应激蛋白。
意大利生物学家里多萨于1962年在研究果蝇的发育时最早发现了热休克现象。
20世纪70年代,科学家进一步发现,细胞在遭受高于正常温度的刺激时,都会大量合成这种蛋白。当遭遇高温或外在的不良刺激时,其他很多蛋白合成都会受到抑制,而让开道路优先合成热休克蛋白。它们在体内有很多重要的作用,最主要的是以“分子伴侣”的身份出现的,顾名思义,就是帮助稳定蛋白质和多肽,当蛋白质发生错误后使之恢复正常,还能降解严重损伤的蛋白质。
特性
普遍性:热休克蛋白能对抗严重的应激损伤,这种现象称为热休克反应 (heatshock response,HSP),热休克反应广泛存在于从原核到真核生物的生物界有机体内。
保守性:HSR是存在于生物系统不同层次结构中的普遍现象。HSR所产生的HSPs从结构到功能都具有极端的保守性,其核酸序列在不同物种之间具有高度的同源性,如大肠杆菌的DnaK基因与真核生物HSP70基因有40-60%的同源性,真核生物间HSPs的同源性可达60-80%。
不仅能为热损伤所诱导,而且可谓许多其它损伤因素及应激刺激,包括物理、化学因素乃至机械刺激(如葡萄糖缺乏、缺血、寒冷、创伤、中毒、重金属、饥饿、缺氧、氧自由基)所诱导,以及其它因素如感染(包括细菌、病毒和寄生虫感染)、恶性肿瘤等所诱导。
随著年龄地增加,热休克蛋白的数量和质量都明显地减少。结果导致形成不活动的、不成形的蛋白质,它们不能支援皮肤。这样慢慢老化,当皮肤的结构紊乱时,皮肤就会不再健壮。
功能作用
提高耐热能力
预先给生物以非致死性的热剌激,可以加强生物对第二次热剌激的抵抗力,提高生物对致死性热剌激的存活率,这种现象称为热耐受。目前对此现象的分子机制仍不太清楚,但许多研究均发现了热休克蛋白的生成量与热耐受呈正相关。
调节Na -K -ATP酶的活性
某些细胞经热休克丧失的Na -K -ATP酶活性可在3℃培养中随着热休克蛋白的产生而得到部分恢复。热休克蛋白的诱导剂亚砷酸钠亦可使Na -K -ATP酶的活性升高。这种现象可被放线菌素D和环己酰亚胺抑制,提示Na -K -ATP酶活性升高是一种基因表达的结果,而不是亚砷酸钠直接作用的结果。
提高应能力
有人通过四膜虫属细胞热休克的研究,发现有些热休克蛋白具有促进细胞内糖原异生和糖原生成的作用,使细胞内糖原贮量增多,从而提高应能力。
增强对损伤的抵抗力
热、乙醇、亚砷酸钠的预处理不仅能使某些细胞产生热耐受,还能使细胞对阿霉素(adriamycin)的耐受性增强,提示热休克蛋白可以增强对各种损伤的抵抗力。
紫外线照射会造成骨胶原流失,是产生皱纹的重要原因。然而若用相当于体温的37摄氏度温水热敷实验鼠,其后背会出现明显皱纹,若用42摄氏度温水热敷,就不会产生皱纹。原因可能是身体暴露于高温时会合成一种热休克蛋白自我保护。研究证明,通过泡澡和热敷的方式可以预防皱纹产生。
应用
在不利的环境中,各种有机体都有其共同对应的分子反应,即正常基因的表达抑制和一组特殊基因,热休克基因的激活和表达,导致热休克蛋白的大量产生,热休克蛋白主要作为分子伴侣而参与蛋白质的折叠、转运及组装等过程,能恢复或加速清除细胞内已变性的蛋白质而稳定细胞结构,细胞产生热耐受。随着对热休克蛋白研究的不断深入,该蛋白质在生物工程和医学等方面的应用前景十分广阔。
Hsp90α
2013年11月17日,清华大学宣布,该校生命学院罗永章教授研究组在国际上首次发现全新的肿瘤标志物——热休克蛋白90α(Hsp90α),其自主研发的Hsp90α定量检测试剂盒已通过临床试验验证,获得了国家第三类(最高类别)医疗器械证书,并通过欧盟认证,获准进入中国和欧盟市场。
这是人Hsp90α被发现24年来,全球首个将其用于临床的产品,对于提高肿瘤患者的病情监测和疗效评价水平、实现肿瘤个体化治疗具有重要推动作用。