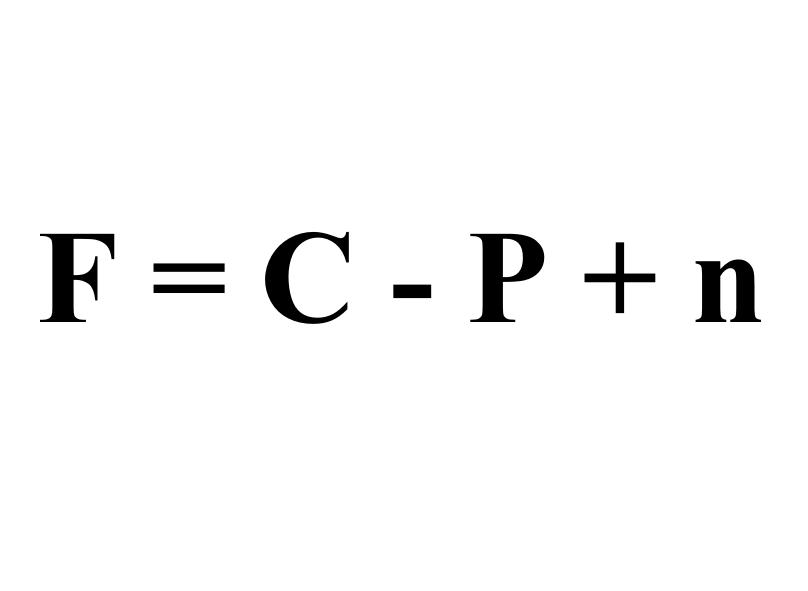定义
热力学平衡条件下系统的组分数、相数和自由度数之间的关系。f=c-P+n,式中c是系统的独立组分数,P是系统的相数,n是除浓度变量外影响系统状态的其他强度性质数(如温度、压力等),f为系统的自由度数。
定律详解
在物理化学,吉布斯相律说明了在特定相态下,系统的自由度跟其他变量的关系。
吉布斯相律是相图的基本原理,它指出:
F = C - P + n
其各个字母表示的含义分别为:
F:自由度
C:系统的组元数(例如化合物的数目)
P:在该点的相态数目
n:外界因素,多数取n=2,代表压力和温度;对于熔点极高的固体,蒸汽压的影响非常小,可取n=1。
以水为例子,只有一种化合物,C=1。在三相点,P=3。F=1-3+2=0,所以温度和压力都固定。
当两种态处于平衡,P=2,对应一个特定压力,便恰好有一个熔点,即有一个自由度。吉布斯相律的预言正确:F=1-2+2=1。
吉布斯相律广泛适用于多相平衡体系,若两相平衡时,压强不相等,则,吉布斯相律不适用。如渗透平衡。
意义及地位
吉布斯的“相律”对于多相体系是具有高度概括性的普适规律,虽然是抽象的,但却是最本质的热力学关系。在“相律”提出前后的一个时期内,曾有一些学者甚至是一些著名学者对相平衡间题独立地作过研究,也得出一些规律,如早期的拉乌尔定律、亨利定律以及“相律”提出后但被埋没的十几年里,比吉布斯出名得多的范霍夫和赫姆霍兹也曾不同程度地进行了研究工作。但这些人的工作都不过是“相律”的某些特例,可见吉布斯的优先权和详尽性是毋容置疑的。
吉布斯相律虽然是研究物质聚集状态之间的相态转变及其平衡的规律,本质上是分子整体运动,应属于分子物理学范畴;但是不同相态(物相)的分子之间的转变,在一定意义上也可视为分子性质的质变,则属于化学范踌。从相变过程在学科发展的历史来看,它一直是化学家研究的世袭领地,因而成为边缘学科—物理化学的一个基本内容。吉布斯相律的重要意义就在于推动了化学热力学及整个物理化学的发展,也成为相关领域诸如冶金学和地质学等的重要理论工具。