疾病概述
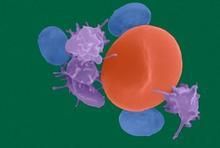
原发性血小板增多症(primary thrombocytosis,PT)是指外周血液中血小板数量超过正常血小板计数的上限400×109/L。主要的病理生理原因:
①克隆性,包括原发性血小板增多症和其他骨髓增殖性疾病;
②反应性或继发性,发生在感染、炎症、肿瘤、手术后、药物、某些生理因素或其他原因;
③家族性或遗传性。
疾病简介
原发性血小板增多症(Primary Thrombocytosis,PT)亦称特发性血小板增多症(Essential Thrombocytosis,ET)或出血性血小板增多症(Hemorrhagic Thrombocytosis)。系克隆性多能干细胞疾病,是骨髓增殖性疾病的一种。其特征是骨髓巨核细胞过度增生,外周血中血小板数量明显增多且伴有质量异常。临床上主要表现为自发性出血倾向和/或血栓形成;约半数病人可有脾肿大。
病因病理
病因不明,经G6PD同工酶检查证实本病也为多能干细胞的克隆性疾病,导致骨髓巨核细胞持续明显增殖,血小板生成增多,加上脾和肝储存血小板的释放,但血小板寿命大多正常。
本病的出血机理由于血小板功能缺陷,粘附及聚集功能减退,血小板第三因子降低,5-羟色胺减少以及释放功能异常。部分病人尚有凝血机制不正常,毛细血管脆性增加。因血小板过多,活化的血小板产生血栓素,易引起血小板的聚集和释放反应,可微血管内形成血栓。晚期可有脾脏和其他脏器的髓外造血。
通常情况下,体内1/3的血小板滞留于脾脏,主要是一些做外科切除脾脏或功能性脾缺失的患者,虽然全身血小板总数趋于正常,但是血小板计数可增多,因而对于这类脾缺失的患者来说出现血小板计数增多属正常,无需进行治疗,与此类似,若注入肾上腺素可以在保持血小板总量不变的情况下,使人们体内血小板从脾脏进入血而产生短暂的血小板升高,血小板计数自发性假性升高还可因球型细胞、Pappenheim小体、红细胞及白细胞碎片或者是细菌的存在而引起。
流行病学
本病发病率低,过去认为本病为所有骨髓增殖性疾病中最少见的一种。但近年的研究发现本病并非少见,甚至高于真性红细胞增多症。据Phekoo报道的一组826例慢性骨髓增殖性疾病病例本病约占慢性骨髓增殖性疾病的36%。1999~2000年度欧洲标准人口统计(ESP)和世界标准人口统计(WSP)报告的PT在所有人群中的标准发病率分别为1.65/10万和1.13/10万。国内发病情况不详,北京协和医院1938~1995年共仅诊治本病22例。
本病发病年龄范围广泛,从2岁到90岁患者均可发病,平均发病年龄60岁,好发于50~70岁之间。据英国东南部地区的一组资料显示其发病年龄为21~99岁,平均年龄为73岁,小于65岁以下者占31%。各年年龄组的发病情况分别为16~24岁组为0.07/10万,25~34岁组为0.37/10万,35~44岁组为1.26/10万,45~54岁组为1.3/10万,55~64岁组为2.52/10万,65~74岁组为6.51/10万,75~84岁组为12.82/10万,85岁以上组为11.1/10万。原发性血小板增多症显示为女性发病为主的骨髓增殖性疾病,男:女约为0.76:1。
原发性血小板增多症的症状
1、病程进展缓慢。
2、主要症状为出血和血栓形成。
3、为自发性或外伤、手术引起的出血。自发性出血多为鼻、牙龈、消化道粘膜出血或皮肤瘀斑。其他部位如泌尿道、呼吸道等也可发生出血。颅内出血虽少
见,但可引起死亡。血栓形成较少见,下肢静脉血栓形成可引起间歇性跛行,肠系膜静脉、脾静脉血栓形成可致腹痛、呕吐、肺、肾、肾上腺或颅内血栓形成,成为
致死原因。
4、本病的巨核细胞异常增生并不局限于骨髓,亦可侵及肝、脾等髓外组织器官,故患者的肝、脾常轻度至中度肿大、化验检查可发现骨髓增生活跃,巨核细胞
系增生尤为突出,原始及幼稚巨核细胞增多,血小板聚集成堆,周围血液中血小板计数高达100万/mm3以上(正常值10~30万/mm3),有巨大、微小
或畸形血小板,常聚集成堆;
5、白细胞计数升高至1~3万/mm3(正常值0.4~1万/mm3),中性粒细胞碱性磷酸酶积分增高;血红蛋白及红细胞计数正常或轻度增多,若患者
有显著出血,可发生低色素性贫血。血小板粘附功能和聚集功能常降低。可有出血时间延长、凝血活酶生成障碍、血块收缩不良。
临床表现
起病缓慢、临床表现轻重不一,约20%的患者,尤其年轻人起病时无症状,偶因验血或发现脾肿大而确诊。轻者仅有头昏、乏力;重者可有出血及血栓形成。出血常为自发性,可反复发作,约见于2/3的病倒,以胃肠道出血常见,也可有鼻衄、齿龈出血、血尿、皮肤粘膜瘀斑,但紫癜少见。血栓发生率较出血少。国内统计30%有动脉或静脉血栓形成。肢体血管栓塞后,可表现肢体麻木、疼痛,甚至坏疽,也有表现红斑性肢痛病。脾及肠系膜血管栓塞可致腹痛、呕吐。肺、脑、肾栓塞引起相应临床症状。脾肿大占80%,一般为轻到中度。少数病人有肝肿大。
发病机制
1.对病因的研究:病因不明。
① 通过对G6PD同功酶的研究发现原发性血小板增多症患者的红细胞、中性粒细胞和血小板仅有一种同功酶,而非造血细胞如纤维母细胞则具有A型和B型两种G6PD同功酶,呈杂合型表现。因而认为本病是一种多能干细胞的克隆性疾病。另外,本病与其他骨髓增殖性疾病有密切的关系,可共同存在和互相转化,亦提示本病的病变发生在多能干细胞水平。由于多能干细胞的异常,导致骨髓中的巨核细胞持续增殖,血小板产率平均可为正常人的6倍,加上过多的血小板从脾和肝脏储存部分释放入周围血液,且本病患者的血小板寿命大多在正常范围,因此,导致血小板计数明显增高。
② 对酪氨酸激酶的分子学研究:新近的研究表明,JAK2作为具有酪氨酸激酶活性的激酶系统,在骨髓增殖性疾病的发病中具有十分重要的作用。当发生JAK2V617F突变时,JAK2V617F作为一种组成性酪氨酸激酶,激活JAK-STAT信号传导系统,导致骨髓细胞产生异常增殖,特别是当JAK2V617F与促红细胞生成素受体(EPOR)、血小板生成素受体(MPL)或粒细胞集落刺激因子受体(G-CSFR)共表达时,这种激活作用更强。JAK2V617F突变在原发性血小板增多症患者中发生率为23%~72%,平均约为50%左右。通过使用不同的方法可检测到这种突变基因的存在,如常规DNA测序法,焦磷酸测序法,解离曲线分析法,等位基因特异PCR方法以及BasXI限制性酶切分析法等均可得到不同程度的良好结果,其中以定量PCR方法为首选。
2.对出血机制的研究:本病的出血发生率约为3.6%~37%,多数出血事件较轻,其发生机制不明。可能原因有①血小板功能缺陷,血小板黏附及聚集功能减退,释放功能异常,血小板肾上腺素受体及前列腺素D2丢失,Fc受体数目增加,血小板糖蛋白(CD36)总含量及表面表达增加,血栓烷A2生成增多,血小板第三因子有效性下降,5-羟色胺减少等。②凝血机制异常,在血小板计数>1,000~1,500X10^9/L以上时出血症状相对多见,可能与von Willebrand因子的获得性缺陷(AvWS)有关。在MPD患者中,AvWS表现为von Willebrand因子多聚体的缺失,导致蛋白功能缺陷,血小板计数持续升高。这种现象也存在于反应性血小板增多症患者,提示出血为血小板数值的绝对升高而非克隆性血小板功能异常所引起。一旦血小板计数降至正常,血浆中von Willebrand因子多聚体水平随之恢复,出血倾向好转。但高血小板计数和AvWS之间的关联的确切机制目前仍不清楚。凝血因子的消耗也是引起出血的原因之一。③血管内血栓形成,造成血管末端梗塞,梗塞区破溃出血。④药物因素,在进行抗血栓、抗凝或抗血小板治疗的过程中,也可能触发严重出血。
3.对血栓形成机制的研究:本病的血栓发生率约为11%~25%,机制不详。血栓形成事件较出血事件为重。动脉血栓多于静脉血栓,血栓可累及大动脉。可发生腹腔血栓事件、红斑性肢痛和一过性神经事件等。可能的机制有①促凝性循环因子的作用,如活化的血小板产生不稳定的因子-血栓素,引起血小板强烈聚集及释放反应,形成微血管栓塞,进一步发展为血栓形成。②血小板的作用:通过对红斑性肢痛症的组织学研究发现该病存在富含vWF和少量纤维蛋白的血小板为主的动脉微血栓,以及本病对阿司匹林高度敏感表明血小板在血栓形成中具有重要作用,然而,仅仅控制血小板数量并不足以防止大多数血栓并发症。③血小板受体和血小板活化:血小板的止血反应与血小板表面受体的数量和质量相关,MPD时存在多种血小板膜蛋白和受体异常,如GPIIb/IIIa、GPIb、GPIV、GPVI、肾上腺素受体、TPO受体cMPL等。有研究表明血小板糖蛋白多态性与血栓形成相关;另外,本病患者血小板活性增加,如P-选择素、血小板反应蛋白和活化的纤维蛋白原受体GPIIb/IIIa表达增加,并与血栓形成有不同程度的相关性;血小板活化特征还包括与促凝活性相关的血小板微粒的形成;血小板活化的精确机制尚不清楚,可能由于患者存在脂氧合酶缺乏,增加内过氧化物TXA2产生效率,或是由于JAK2激活性突变、异常HCT的作用、湍流或TPO水平增加等。④血小板与白细胞和内皮细胞的相互作用:测定ET患者的中性粒细胞、内皮损伤(TM和vWF抗原)、凝血酶活化的标志物水平(TAT复合物、F1+2和D-二聚体)结果表明,与对照组相比本病存在中性粒细胞活化、内皮损伤和高凝。ET患者VEGF水平增加,使内皮活化增加。活化的白细胞通过颗粒内容物释放,与血小板聚集而促进血液凝固。有微血管血栓事件者其血小板-白细胞聚集百分率增加,这种聚集在触发单核细胞TF表达以及超氧化阴离子和炎性细胞释放引起的内皮活化和损伤中具有致病作用;同时这种聚集还与活化指标CD11b和CD62P的表达相关。另外,血小板上CD62P和中性粒细胞上的P-选择素糖蛋白配体-1结合而形成一种粘附链,并随着CD11b与血小板GPIb或结合于血小板GPIIb/IIIa上的纤维蛋白原的结合而形成更稳固的黏附。⑤红细胞压积的作用:HCT是体外全血粘度的主要指标,但在体内血流动力和动脉氧合也对流变学有影响。HCT可以影响血小板活化和血小板与白细胞和血管壁的作用机会,其增加将造成血浆/血小板区域缩小,进一步加剧促凝效应。
病理生理
由于血小板极度增生而造成微血管血栓性损害。脾充血,可有广泛性栓塞,少数病例有脾纤维化和脾萎缩。血栓可发生于下肢静脉、脾静脉、肠系膜静脉以及肾、肺、脑等不同部位。随着血栓的形成,相应部位可产生坏死及(或)继发性萎缩性病变等。本病可有骨髓外浸润,巨核细胞系的增生不仅限于骨髓,亦可累及骨髓外组织,主要是肝、脾等组织内出现髓外以巨核细胞系为主的增生灶。由于本病恶性程度较低,增长速度较慢,肝、脾多呈轻、中度肿大。
化验检查
(一)血象血小板计数多在100万~300万/mm3,最高达2000万/mm3。血片中血小板聚集成堆、大小不一,有巨大畸形变,偶也见到巨核细胞碎片及裸核。白细胞数可正常或增高,多在1万~3万/mm3,一般不超过5万/mm3,分类以中性分叶核粒细胞为主,偶见幼粒细胞。30%的患者红细胞数正常或轻度增多,形态大小不一,呈多染性,也可出现豪-胶小体及嗜碱性点彩。少数病人有反复出血而导致低色素性贫血。
(二)骨髓象有核细胞尤其是巨核细胞显著增生,原及幼巨核细胞增多,血小板聚集成堆。中性粒细胞的碱性磷酸活性增加。
(三)出、凝血试验出血时间延长,凝血酶原则消耗时间缩短,血块退缩不良,凝血酶原时间延长,凝血活酶生成障碍。血小板粘附功能及肾上腺素和ADP诱导的聚集功能均降低,但对胶原聚集反应一般正常。
(四)其他染色体检查有21号长臂缺失(21q-),也有报告21号染色体长臂大小不一的变异。血清酸性磷酸酶、钾、钙、磷、乳酸脱氢酶及尿酸含量测定均增多。
诊断鉴别
对原因不明血小板增多(>60万/mm3),骨髓中巨核细胞显著增加,结合脾大,出血或血栓形成等表现,应考虑本病的诊断。但需与继发性(或反应性)血小板增多症及其他骨髓增生性疾病相鉴别。
继发性血小板增多症见于脾切除后、脾萎缩、急或慢性失血、外伤及手术后。慢性感染、类风湿性关节炎、风湿病、坏死性肉芽肿、溃疡性结肠炎、恶性肿瘤、分娩、肾上腺素等药物反应也可引起血小板增多。有报道骨髓细胞培养,原发性血小板增多症有自发性巨核细胞集落形成,可与继发性区别。
治疗
治疗目的要求血小板减少至正常或接近正常,以预防血栓及出血的发生。
(一)骨髓抑制性药物白消安为常用有效的药物,宜用小剂量,开始4~6mg/d。如要求血小板快速下降可选用羟基脲2~4g/d,3~4天后减至1g/d。环磷酰胺,苯丁酸氮芥,马法兰等都有效。当血小板数下降或症状缓解后即可停药。如有复发可再用药。
(二)放射核素磷(32P)口服或静脉注射,首次剂量0.08~0.11MBq,如有必要三月后再给药一次。一般不主张应用,因为诱发白血病的可能。
(三)血小板分离术迅速减少血小板数量,改善症状。常用于胃肠道出血、妊娠及分娩、选择性手术前。
(四)干扰素最近有人提出用α干扰素治疗原发性血小板增多症。可对巨核细胞生成抑制及血小板生存期缩短。剂量为3~5mu/d。
(五)其他应用双嘧达莫、阿司匹林、消炎痛可防止血小板聚集。有血栓形成者用肝素或双香豆素类抗凝药。切脾是禁忌的。
预防
根据血小板增多的程度,病程不一。大多数病例进展缓慢,中位生存期常在10~15年以上。少数病人可转为骨髓纤维化,真性红细胞增多症或慢性粒细胞白血病。重要脏器有血栓形成及出血常为本病致死的主要原因。
预防原发性血小板增多症
1、临床无多血质表现,外周血中红细胞和血红蛋白不升高而血小板极度升高,骨髓象无明显的红细胞系统增生而巨核细胞系统却增生极度活跃可与真性红细胞增多症鉴别。(推荐阅读:血小板增多症的有哪些症状表现及危害呢)
2、无切脾病史,出血时间,血小板粘附和聚集功能降低等可与脾切除术后的血小板增多症鉴别。