要点
书写步骤
1.写出反应物和生成物的化学式。
例:NaHCO3=Na2CO3+H2O+CO2↑
2.配平。
例:2NaHCO3=Na2CO3+H2O+CO2
3.注明反应条件和物态等。
例:2NaHCO3=Na2CO3+H2O+CO2↑
4.检查化学方程式是否正确。
反应条件
1.热化学方程式不写反应条件。写上是否正确,没有定论,但中学所有资料中不写。配平系数也可以不是1,可以是分数或者相互之间可以约分。
2.常温常压下可以进行的反应,不必写条件;但是题目中的实验若有特定的条件,一律标注该特定条件。
3.反应单一条件时,条件一律写上面;有两个或更多条件的,上面写不下的写在下面;既有催化剂又有其它反应条件时,一律把催化剂写在上面。
4.是可逆反应的一律用双向箭头表示。
箭头与等号
在专业领域的文献中,不论无机、有机反应方程式中均使用箭头号“→”来连接反应物和生成物。国外化学教科书、上海市中学化学二期课改教材(上海科学技术出版社2006年7月,姚子鹏主编)、上海高考的化学卷、理综卷中也采用了箭头号。但在多数省市的中学教学中,仍建议按照教材在书写无机化学反应方程式时使用等号,以更好地表示反应中的“生成”与“质量守恒”含义。(2011-2012苏教版也用的箭头)
2013年中学阶段无机反应方程式一律用等号连接反应物和生成物,有机反应一律用箭头来连接反应物和生成物,是可逆反应的一律用双向箭头表示。
气体符号与沉淀符号
1.气体符号“↑”和沉淀符号“↓”是化学反应中生成物的状态符号。只有生成物才能使用“↑”或“↓”符号,使用时写在相应化学式的右边。
2.当生成物在常温常压下(通常指25℃、101.3kPa)是气态的,才用“↑”号,如:
NH4HCO3=Δ=NH3↑+H2O+CO2↑,但还必须同时注意两点:
(1)若反应物中有一种或几种气态物质(常温常压下)则生成的气态物质不再用“↑”号,如:
C+O2=点燃=CO2
CH4+2O2=点燃=CO2+2H2O
(2)不论反应物状态如何,只要产物只有一种物质,且是气体时也不用“↑”。
3.在溶液中进行的化学反应,有难溶物质或不溶物质生成时,用“↓”号表示。如:
HCl+AgNO3==AgCl↓+HNO3
4.若反应不是在溶液中进行的,就不存在沉淀析出现象,不能用“↓”号。如:2HgO=△=2Hg+O2↑
5.对于金属与盐溶液之间的置换反应,生成的金属单质,由于覆盖在金属的表面,没有沉淀析出,不应使用“↓”号,如:Fe+CuSO4==FeSO4+Cu
6.在复分解反应中,若生成物是微溶物时,应把它视为“沉淀”,标上“↓”。如:MgSO4+Na2CO3==Na2SO4+MgCO3↓
7.必须以客观事实为依据,即使是同一个化学反应,也必须要看具体情况。如硫化氢与二氧化硫气体混合反应生成硫,不用沉淀符号,即2H2S+SO2==2H2O+3S
当把二氧化硫通入到氢硫酸的溶液中时,溶液中出现了黄色的浑浊现象,生成的单质硫应标上“↓”,即2H2S+SO2==2H2O+3S↓
又如向氯化银悬浊液中滴加硫化钠溶液,白色沉淀变成黑色,发生了沉淀的转化,生成的硫化银应标上“↓”,即2AgCl+Na2S==Ag2S↓+2NaCl
物质状态
热化学
加热化学方程式需要标出每一个反应物、生成物的状态,可分g(气体)、l(液体)、s(固体)、aq(溶液)四大类。字母外需要打括号,例如H₂O(l)、Na₂CO₃(aq)、CaCO₃(s)。
普通方程式则不是很严格,一般不用g、l、s、aq的标记。生成物方面,当反应物中不含气体时,气体生成物要用“↑”标记;只有在溶液中,反应物中不含固体时,难溶或固体生成物一律用“↓”标记(如电解池反应:CuCl₂=Cu+Cl₂↑,由于生成Cu吸附在电极上,故不写“↓”)。
水蒸气
水蒸气一般不打箭头,但偶有例外(碳酸氢铵受热分解)。
反应物状态的不同
反应物若以特殊状态参加反应,例如浓硫酸、熔融氧化铝,过量,少量,一律在相应的反应物后打括号注明状态
<1>反应物的浓度不同,产物不同
Cu+4HNO₃(浓)=Cu(NO₃)₂+2NO₂↑+2H₂O
3Cu+8HNO₃(稀)=3Cu(NO₃)₂+2NO↑+4H₂O
<2>反应物的量不同,产物不同
2NaOH+CO₂(少量)=Na₂CO₃+H₂O
NaOH+CO₂(过量)=NaHCO₃
<3>反应物的物态不同,产物不同
2NaCl+2H₂O=通电=2NaOH+H₂↑+Cl₂↑
2NaCl(熔融)=通电=2Na+Cl₂↑
化学方程式中,有机物需要用结构简式燃烧反应无需考虑有机物结构,因此理论上可以写分子式。(但还是写结构简式为妙。)
个别相对复杂的有机物允许写分子式(例如葡萄糖),但是在相应的分子式下方要用中文注明反应物名称,并打括号。
无机物一般使用分子式而不用结构简式(例如硝酸通常不写为HO-NO2)。
正文
用化学式表明化学变化的式子,也称化学反应式。例如氢气和氧气发生化学变化生成了水,可以用下列化学方程式表示:反应物的化学式写在左边,生成物(也叫产物)的化学式写在右边,中间以等号相连。按质量守恒定律,反应前后各元素原子数目不变,所以各化学式前面应加上适当的系数,使方程式两边的原子数目相等。例如在上式中H2的系数为2,O2为1,H2O为2,则左边和右边都是4个氢原子和2个氧原子。在讨论化学平衡问题时常用代替以强调反应的可逆性。也有时用─→代替,以强调反应的单向性,或用─→表示同时发生副反应。
化学方程式不仅表明反应物、生成物各是哪些物质,而且还表明了它们之间的质量关系。如上述化学方程式表示2摩尔H2和1O2
起反应,生成了2摩尔H2O, 也表示4.03176克氢气和31.9988克氧气起反应,生成了36.03056克的水。所以,按照化学方程式可以进行基本化学计算。
电解质在水溶液里电离成离子,离子间的化学变化可以用离子化学方程式表示。例如氯化钡溶液和硫酸钠溶液相作用,发生反应的是钡离子和硫酸根离子,所以它们的离子化学方程式是:Ba +SO厈─→BaSO4
Na 和Cl 在溶液中没有发生变化,所以可以不列入方程式,这种化学方程式简称离子方程式。
化学变化总是伴随着热量变化,凡注明热量变化的化学方程式叫做热化学方程式。例如,1摩尔碳和1摩尔氧在25℃、1大气压条件下生成1摩尔二氧化碳时,总是放出393千焦的热,它们的热化学方程式是:C(s)+O2(g)─→CO2(g)ΔH=-393kJ式中s表示固态,g表示气态,若是液态则用l表示。ΔH代表反应热,负值表示放热反应,即生成物的焓小于反应物;正值表示生成物的焓大于反应物,是吸热反应。
要领技巧
化学式在化学用语系列中,处于承上启下的地位,前有元素符号和化合价知识,这是书写化学式的基础;后有化学方程式和电离方程式等,这又是以化学式为基础的,其中如有一个化学式错误,则全式毫无意义,若再以这样的错误化学方程式作依据进行化学计算,则错得更远,真可谓是“失之毫厘,差之千里”。可见,掌握书写化学式的要领,直接影响着其他化学用语、其他化学知识和技能的学习。
初中化学中,出现的不同物质的化学式有一百多个。记忆和书写物质的化学式,绝不能靠死记硬背,而应掌握其书写要领,只要常写常练,便能较快地达到熟练的程度。
要正确书写物质的化学式,一是要熟练记忆元素符号,二是书写化合物的化学式时,要熟练记忆常见元素和原子团的化合价,三是书写化合物的化学式要符合各元素正负化合价的代数和为零的原则,四是掌握书写化学式的一般方法。总起来说,这就是书写化学式的要领。
化学式的一般写法是:
(1)单质的化学式
除H2、O2、N2、F2、Cl2、Br2和I2七种单质为双原子分子外,其余单质(稀有气体、金属单质和固态非金属单质等)都是以元素符号表示其化学式。
(2)化合物的化学式
书写时一般规律是先读后写,后读先写;排好顺序,写好角号。一般将显正价的元素或原子团写在左边,显负价的元素或原子团写在右边。其书写步骤是:定位、标价、交叉约简和检验四步。
例如:写出氧化铝、磷酸、氢氧化铜和硫酸铁的化学式。
①定位:确定元素或原子团的顺序。
AlO、HPO4、CuOH、FeSO4
②标价:正确地在各元素或原子团的上方标出化合价。
③交叉约简:将化合价的绝对值交叉写在对方元素或原子团的右下方,能约简的要约为最简约数。原子或原子团的个数为1时,通常1省去不写。原子团在2个或2个以上时,应加上括号。
④检验:当正价总数与负价总数之和为零时,化学式正确。
Al2O3、H3PO4、Cu(OH)2、Fe2(SO4)3
上述步骤是对初学者而言,写得多了,熟练了,便可得心应手一次写出。要注意的是,化学式表示某物质的组成,因此,只有某种物质是确实存在的,表示这种物质的化学式才有意义。不是任意两种或两种以上的元素都能化合成化合物,所以,我们不能随意写出一种客观上不存在的物质的化学式。
书写的技巧
1.书写化学方程式的步骤
以书写碳在高温时跟氧化铁反应的化学方程式为例,归纳步骤如下:
①根据反应的事实(该反应生成铁和二氧化碳气体),在式子的左边写出反应物的化学式,在式子的右边写出生成物的化学式。反应物或生成物不止一种,就分别用加号把它们连接起来(反应物之间的“+”号表示“……跟……反应”,生成物之间的“+”号表示“……跟……”),并在式子左、右之间划一条短线段。在这一步里,一定要注意把各种物质的化学式写正确,否则,写出的式子无意义!
C+Fe2O3──Fe+CO2
②根据质量守恒定律,用配系数的方法,使左、右两边同一元素原子的个数相等(即配平),然后将短线段改为等号(等号表示“生成了……”)。应当注意,配平时只能选择适当的系数,不能改变化学式。
3C+2Fe2O3=4Fe+3CO2
③在等号或箭号上、下方注明反应条件,如点燃、通电、高温、加热(用“△”号表示)、催化剂等,同时,标明生成物中的气体或沉淀产物的状态。生成物是气体的在其化学式的右边加上“↑”号(反应物中如有气体,则气态生成物不再标“↑”符号);产物是沉淀的加“↓”号。
3C+2Fe2O3=4Fe+3CO2↑
概而言之,在书写化学方程式时,必须要符合化学反应的客观规律,不能凭空臆造。书写程序一般是:写好化学式—系数要配平—中间联等号—条件要注清—生成气体或沉淀,要用箭号来标明。
要写好化学方程式,还要熟练掌握和运用酸、碱、盐的溶解性表,金属活动性顺序和常见元素、原子团的化合价,以及书写物质化学式的技能。
2.化学方程式书写中常见错误简析
化学方程式的书写,是元素符号和化学式书写能力的综合运用,因而也是化学用语学习中显得尤为重要和难度较大的部分。
这里,跟同学们谈一谈书写化学方程式中应注意避免的几种错误,概括起来,主要有“四乱”。
一是乱套“公式”。一些同学书写化学方程式时,虽然注意了不能凭空臆造化学式,但又没有掌握典型记忆与类型推导相结合的方法,加之缺乏化学基础知识,因而把记住的某个熟悉的化学方程式当作为一般公式去套用,犯了乱套“公式”的错误。如:
当然,某些化学性质相似的物质,可以发生一些相似的化学反应,这在典型记忆与类型推导相结合的方法中已叙述过。
由此可见,书写化学方程式不一定象数学、物理上那样,有固定的公式可套,而是要根据反应物的性质和反应的条件,运用化学基础知识和理论来推测反应能否发生,从而写出正确的化学方程式来。
二是乱写逆反应。如:
产生此类错误的原因是,初中学生把化学方程式与数理方程式混为一谈,随意把化学方程式倒过来写。我们知道,数理方程式可以移项,或将等号左右两端反过来写;而化学方程式与数理方程式是绝然不同的两种概念。虽然有些化学反应是可逆的,但多数化学反应并非如此。至于有些反应,在相同或不相同的条件下,能够向相反方向进行,也不一定是可逆反应,而是意义完全相反的反应类型。
上述情况,虽在独立场合都正确,但绝不能相互代替。
此外,对于复分解反应中,除注意生成物中要有沉淀析出、放出气体或生成水的条件才能使反应发生外,还应注意在盐与碱、盐与盐的反应中,盐和碱都必须是可溶性的电解质。否则反应照样不能发生。
三是乱标生成物的状态和反应条件。如:
四是乱写化学式。例如:
H2+O2=H2O2
Na+Cl=NaCl
NaOH+CuSO4=NaSO4+CuOH
Al+H2SO4=AlSO4+H2↑
这类错误较为严重。这是对物质的化学式的书写规则不懂或没有入门造成的。克服的办法是:在书写每一个化学式时,都要运用化合价规则去检验校正,在所有化学式都正确的基础上再进行配平。
例6配平下列化学方程式
(1)Fe2O3+CO→Fe+CO2
(2)FeS2+O2→Fe2O3+SO2
(3)C2H2+O2→CO2+H2O
计算
一.重点和难点
重点:根据化学方程式计算的方法、格式和步骤。
难点:不纯物的计算。
二.具体步骤
1.根据化学方程式的计算
化学方程式不仅表示什么物质参加反应和反应后生成什么物质,而且还表示反应物和生成物各物质间的质量比。根据化学方程式的计算就是依据反应物和生成物之间的质量比进行的。因此,已知反应物的质量可以算出生成物的质量;已知生成物的质量可以算出反应物的质量;已知一种参加反应的反应物的质量可以算出另一种参加反应的反应物的质量;已知一种生成物的质量可以算出另一种生成物的质量。
化学计算题是从“量”的方面来反映物质及其变化规律的。化学计算包括化学和数学两个因素,其中化学知识是数学计算的基础,数学又是化学计算的工具。根据化学方程式的计算,必须对有关的化学知识有清晰的理解,熟练掌握有关反应的化学方程式。如果化学方程式中的化学式写错了,或者没有配平,化学计算必然会得出错误结果。
2.根据化学方程式计算的步骤
(1)根据题意设未知量。
(2)根据题意写出正确的化学方程式。
(3)写出有关物质的相对分子质量或相对分子质量和以及已知量和未知量。写在化学方程式的相对应的化学式的下面。
(4)列比例式,求解。
(5)简明的答题。
3.根据化学方程式计算的注意事项
(1)解题格式必须规范。
(2)根据化学方程式计算是以纯净物的质量进行计算,对于不纯的反应物或不纯的生成物必须折算成纯净物的质量,再进行计算。
(3)必须正确使用单位。
4.根据化学方程式计算时,常见的错误:
(1)不认真审题,答非所问。
(2)元素符号或化学式写错。
(3)化学方程式没有配平。
(4)相对分子质量计算错误。
(5)单位使用错误。
(6)把不纯物质当成纯净物进行计算。
配平方法
最小公倍数法
A、找出原子个数较多,且在反应式两边各出现一次的原子,求它的最小公倍数。
B、推出各分子的系数。
例如:
第一步:CuSO4+NaOH----Cu(OH)2+Na2SO4
第二步:CuSO4+2NaOH----Cu(OH)2+Na2SO4(配平)
第三步:CuSO4+2NaOH====Cu(OH)2↓+Na2SO4(注明生成物物态)
观察法
从化学式较复杂的一种生成物推算有关各反应物化学式的化学计量数和该生成物的化学计量数;根据求得的化学式的化学计量数,再找出其他化学式的化学计量数,直至配平。
例如:第一步H2O(g)+Fe---Fe3O4+H2
第二步4H2O(g)+3Fe---Fe3O4+H2
第三步4H2O(g)+3Fe====Fe3O4+4H2(反应条件:加热)
奇偶配平法
看哪种元素在反应化学方程式左右两边出现次数最多;从该元素个数为奇数的化学式入手,将其配成偶数(即化学计量数为2);由它求得的化学计量数配平其他化学式的化学计量数,使两边原子个数相等。
例:配平
H2O(g)+Fe---Fe3O4+H2
第一步:配平氧原子
4H2O(g)+Fe---Fe3O4+H2
第二步:配平氢原子、铁原子
4H2O(g)+3Fe---Fe3O4+4H2
第三步:配平后的化学方程式:
4H2O(g)+3Fe====Fe3O4+4H2(反应条件:加热)
4、待定化学计量数法
以不同的未知数代表化学方程式中各化学式的化学计量数;根据质量守恒定律,反应前后各原子的种类不变、各原子的数目相等,列出数学方程组;解方程组,并令其中任一未知数为1,求出其他未知数的值;最后将未知数的数值代入原化学方程式。
例如:NH3+Cl2----NH4Cl+N2
设各物质的化学计量数依次为a、b、c、d。
aNH3+bCl2----cNH4Cl+dN2
列方程组a=c+2d(满足氮原子数相等)
3a=4c(满足氢原子数相等)
2b=c(满足氯原子数相等)
令b=1,解得:a=8/3,c=2,d=1/3
8NH3+3Cl2====6NH4Cl+N2(由于系数不能为小数,所以a,b,c,d均扩大3倍得出)
5、化合价升降法
一、配平原则由于在氧化还原反应里存在着电子的转移,因此元素的化合价必然有升有降,我们把化合价能升高的元素或含该元素的物质称还原剂;反之称为氧化剂。由氧化还原反应的知识我们不难得出配平原则:还原剂失电子总数=氧化剂得电子总数,即还原剂(元素)化合价升高的价数=氧化剂(元素)化合价降低的价数。
二、氧化还原反应方程式配平的一般方法与步骤
1、一般方法:从左向右配。
2、步骤:标变价、找变化、求总数、配系数。
即:⑴标出变化元素化合价的始态和终态;
⑵始态终态变化的总价数=变化×系数
注:假设以上变化均以正价表示,其中(b-a)×(d-c)为最小公倍数。
⑶将上的系数,分别填在还原剂和氧化剂化学式的前面作为系数;
⑷用观察法配平其它元素;
⑸检查配平后的方程式是否符合质量守恒定律(离子方程式还要看是否符合电荷守恒)
得氧失氧法
对于氧化还原反应,先观察得出氧化剂失氧的数目,再观察得出还原剂得氧的数目,然后配平
比如:3CO+Fe2O3====2Fe+3CO2
氧化剂氧化铁反应前后失掉三个氧,还原剂一氧化碳反应前后得到一个氧,所以需要三个一氧化碳才能夺去氧化铁中的氧,一氧化碳、二氧化碳配3,铁配2
指姆大法
有种外挂叫指姆大法,它是由蔡哥(蔡显刚)老师发明。
普通的完全氧化还原反应,可用两对反应物与生成物元素化合价升或降价的差约分交叉成为系数,然后配平。例如:C+H2SO4——CO2+SO2+H2OC的化合价为0,CO2中C的化合价为+4,两者价相差4。H2SO4中S的化合价为+6,SO2的化合价为+4,两者价相差2。两元素的价差比(C:S)为4:2=2:1,交换为1:2,即反应中1个C对应2个H2SO4,即1C+2H2SO4——CO2+SO2+H2O,然后配平为C+2H2SO4=CO2+2SO2+2H2O
普通部分氧化还原反应在后边变价的位置放手指,歧化反应必须在后边放,归中反应一般在前面放。有关于有机物参加反应的配平,有机物中的氢永远为+1价,O永远为-2价,碳的化合价设X解(可能为分数)。
金属单质
还原性
4HCl(浓)+MnO2=MnCl2+Cl2+2H2O
4HCl(g)+O2=2Cl2+2H2O
16HCl+2KMnO4=2KCl+2MnCl2+5Cl2+8H2O
14HCl+K2Cr2O7=2KCl+2CrCl3+3Cl2+7H2O
2H2O+2F2=4HF+O2
2H2S+3O2(足量)=2SO2+2H2O
2H2S+O2(少量)=2S+2H2O
2H2S+SO2=3S+2H2O
H2S+H2SO4(浓)=S+SO2+2H2O
3H2S+2HNO3(稀)=3S+2NO+4H2O
5H2S+2KMnO4+3H2SO4=2MnSO4+K2SO4+5S+8H2O
3H2S+K2Cr2O7+4H2SO4=Cr2(SO4)3+K2SO4+3S+7H2O
2高中化学方程式小结(仅供参考)
H2S+4Na2O2+2H2O=Na2SO4+6NaOH
2NH3+3CuO=3Cu+N2+3H2O
2NH3+3Cl2=N2+6HCl
8NH3+3Cl2=N2+6NH4Cl
4NH3+3O2(纯氧)=2N2+6H2O
4NH3+5O2=4NO+6H2O
4NH3+6NO=5N2+6H2O(用氨清除NO)
NaH+H2O=NaOH+H2
4NaH+TiCl=Ti+4NaCl+2H2
CaH2+2H2O=Ca(OH)2+2H2
酸性
4HF+SiO2=SiF4+2H2O
(此反应广泛应用于测定矿样或钢样中SiO2的含量)
2HF+CaCl2=CaF2+2HCl
H2S+Fe=FeS+H2
H2S+CuCl2=CuS+2HCl
H2S+2AgNO3=Ag2S+2HNO3
H2S+HgCl2=HgS+2HCl
H2S+Pb(NO3)2=PbS+2HNO3
H2S+FeCl2=FeS+2HCl↑
2NH3+2Na=2NaNH2+H2
NaNH2+H2O=NaOH+NH3
碱性
NH3+HCl=NH4Cl
NH3+HNO3=NH4NO3
2NH3+H2SO4=(NH4)2SO4
NH3+NaCl+H2O+CO2=NaHCO3↓+NH4Cl
(此反应用于工业制备小苏打,苏打)
不稳定性:
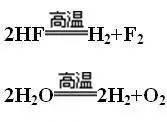
2HF—X—H2+F2(氟化氢很稳定,既不会被高锰酸钾或二氧化锰所氧化,也不会在高温分解)
2HCl=H2+Cl2
2H2O=2H2+O2(水在高温可以分解)
2H2O2=2H2O+O2
H2S=H2+S
2NH3=N2+3H2非金属氧化物低价态的还原性:
2SO2+O2=2SO3
2SO2+O2+2H2O=2H2SO4
(这是SO2在大气中缓慢发生的环境化学反应)
SO2+Cl2+2H2O=H2SO4+2HCl
SO2+Br2+2H2O=H2SO4+2HBr
SO2+I2+2H2O=H2SO4+2HI
SO2+NO2=SO3+NO
2NO+O2=2NO2
NO+NO2+2NaOH=2NaNO2+H2O
(用于制硝酸工业中吸收尾气中的NO和NO2)
2CO+O2=2CO2
CO+CuO=Cu+CO2
3CO+Fe2O3=2Fe+3CO2
CO+H2O=CO2+H2
氧化性
SO2+2H2S=3S+2H2O
SO3+2KI=K2SO3+I2
NO2+2KI+H2O=NO+I2+2KOH
(不能用淀粉KI溶液鉴别溴蒸气和NO2)
4NO2+H2S=4NO+SO3+H2O
2NO2+Cu=4CuO+N2
CO2+2Mg=2MgO+C
(CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)
SiO2+2H2=Si+2H2O
SiO2+2Mg=2MgO+Si
与水的作用:
SO2+H2O=H2SO3
SO3+H2O=H2SO4
3NO2+H2O=2HNO3+NO↑
N2O5+H2O=2HNO3
P2O5+H2O=2HPO3
P2O5+3H2O=2H3PO4
(P2O5极易吸水,可作气体干燥剂)
P2O5+3H2SO4(浓)=Δ=2H3PO4+3SO3↑(SO3是白色固体,但加热会变成气体)
CO2+H2O<===>H2CO3(可逆)
与碱性物质的作用:
SO2+2NH3+H2O=(NH4)2SO3
SO2+(NH4)2SO3+H2O=2NH4HSO3
(这是硫酸厂回收SO2的反应.先用氨水吸收SO2,
再用H2SO4处理:2NH4HSO3+H2SO4=(NH4)2SO4+2H2O+2SO2
生成的硫酸铵作化肥,SO2循环作原料气)
SO2+Ca(OH)2=CaSO3+H2O
(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)
SO3+MgO=MgSO4
SO3+Ca(OH)2=CaSO4+H2O
CO2+2NaOH(过量)=Na2CO3+H2O
CO2(过量)+NaOH=NaHCO3
CO2+Ca(OH)2(过量)=CaCO3+H2O
2CO2(过量)+Ca(OH)2=Ca(HCO3)2
CO2+2NaAlO2+3H2O=2Al(OH)3+Na2CO3
CO2+C6H5ONa+H2O=C6H5OH+NaHCO3
SiO2+CaO=CaSiO3
SiO2+2NaOH=Na2SiO3+H2O
(常温下强碱缓慢腐蚀玻璃)
SiO2+Na2CO3=Na2SiO3+CO2↑
SiO2+CaCO3=CaSiO3+CO2↑金属氧化物低价态的还原性:
6FeO+O2=2Fe3O4
FeO+4HNO3=Fe(NO3)3+NO2↑+2H2O
氧化性
Na2O2+2Na=2Na2O
(此反应用于制备Na2O)
MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al.
一般通过电解制Mg和Al.
Fe2O3+3H2=2Fe+3H2O(制还原铁粉)
与水的作用:
Na2O+H2O=2NaOH
2Na2O2+2H2O=4NaOH+O2↑
(此反应分两步:Na2O2+2H2O=2NaOH+H2O2;
2H2O2=2H2O+O2↑.H2O2的制备可利用类似的反应:
BaO2+H2SO4(稀)=BaSO4+H2O2)
MgO+H2O=Mg(OH)2(缓慢反应)
与酸性物质的作用:
Na2O+SO3=Na2SO4
Na2O+CO2=Na2CO3
Na2O+2HCl=2NaCl+H2O
2Na2O2+2CO2=2Na2CO3+O2
Na2O2+H2SO4(冷,稀)=Na2SO4+H2O2
MgO+SO3=MgSO4
MgO+H2SO4=MgSO4+H2O
Al2O3+3H2SO4=Al2(SO4)3+3H2O
(Al2O3是两性氧化物:Al2O3+2NaOH=2NaAlO2+H2O)
FeO+2HCl=FeCl2+3H2O
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2S(g)=Fe2S3+3H2O
Fe3O4+8HCl=FeCl2+2FeCl3+4H2O含氧酸氧化性:
4HClO3+3H2S=3H2SO4+4HCl↑
HClO3+HI=HIO3+HCl↑
3HClO+HI=HIO3+3HCl↑
HClO+H2SO3=H2SO4+HCl↑
HClO+H2O2=HCl+H2O+O2↑(氧化性:HClO>HClO2>HClO3>HClO4,但浓,热的HClO4氧化性很强)
2H2SO4(浓)+C=CO2↑+2SO2↑+2H2O
2H2SO4(浓)+S=3SO2↑+2H2O
H2SO4+Fe(Al)室温下钝化
6H2SO4(浓)+2Fe=加热=Fe2(SO4)3+3SO2↑+6H2O
2H2SO4(浓)+Cu=CuSO4+SO2↑+2H2O
H2SO4(浓)+2HBr=SO2↑+Br2+2H2O
H2SO4(浓)+2HI=SO2↑+I2+2H2O
H2SO4(稀)+Fe=FeSO4+H2↑
2H2SO3+2H2S=3S+2H2O
4HNO3(浓)+C=CO2+4NO2↑+2H2O
6HNO3(浓)+S=H2SO4+6NO2↑+2H2O
5HNO3(浓)+P=H3PO4+5NO2↑+H2O
6HNO3+Fe=Fe(NO3)3+3NO2↑+3H2O
4HNO3+Fe=Fe(NO3)3+NO↑+2H2O
30HNO3+8Fe=8Fe(NO3)3+3N2O+15H2O
36HNO3+10Fe=10Fe(NO3)3+3N2↑+18H2O
30HNO3+8Fe=8Fe(NO3)3+3NH4NO3+9H2O
还原性:
H2SO3+X2+H2O=H2SO4+2HX(X表示Cl2,Br2,I2)
2H2SO3+O2=2H2SO4
H2SO3+H2O2=H2SO4+H2O
5H2SO3+2KMnO4=2MnSO4+K2SO4+2H2SO4+3H2O
H2SO3+2FeCl3+H2O=H2SO4+2FeCl2+2HCl↑
酸性
H2SO4(浓)+CaF2=CaSO4+2HF↑
H2SO4(浓)+NaCl=NaHSO4+HCl↑
H2SO4(浓)+2NaCl=Na2SO4+2HCl↑
H2SO4(浓)+NaNO3=NaHSO4+HNO3
3H2SO4(浓)+Ca3(PO4)2=3CaSO4+2H3PO4
2H2SO4(浓)+Ca3(PO4)2=2CaSO4+Ca(H2PO4)2
3HNO3+Ag3PO4=H3PO4+3AgNO3
2HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑(用HNO3和浓H2SO4不能制备H2S,HI,HBr,(SO2)
等还原性气体)
4H3PO4+Ca3(PO4)2=3Ca(H2PO4)2(重钙)
H3PO4(浓)+NaBr=NaH2PO4+HBr
H3PO4(浓)+NaI=NaH2PO4+HI
不稳定性:
2HClO=2HCl+O2↑
4HNO3=4NO2↑+O2↑+2H2O
H2SO3=H2O+SO2↑
H2CO3=H2O+CO2↑
H4SiO4=H2SiO3+H2O碱低价态的还原性:
4Fe(OH)2+O2+2H2O=4Fe(OH)3
2NaOH+SO2(少量)=Na2SO3+H2O
NaOH+SO2(足量)=NaHSO3
与酸性物质的作用:
2NaOH+SiO2=NaSiO3+H2O
2NaOH+Al2O3=2NaAlO2+H2O
2NaOH+Cl2=NaCl+NaClO+H2O
NaOH+HCl=NaCl+H2O
NaOH+H2S(足量)=NaHS+H2O
2NaOH+H2S(少量)=Na2S+2H2O
3NaOH+AlCl3=Al(OH)3+3NaCl
NaOH+Al(OH)3=NaAlO2+2H2O(酸性:AlCl3>Al(OH)3)
NaOH+NH4Cl=NaCl+NH3+H2O
Mg(OH)2+2NH4Cl=MgCl2+2NH3.H2O
不稳定性
Mg(OH)2=MgO+H2O
2Al(OH)3=Al2O3+3H2O
2Fe(OH)3=Fe2O3+3H2O
Cu(OH)2=CuO+H2O盐氧化性:
2FeCl3+Fe=3FeCl2
2FeCl3+Cu=2FeCl2+CuCl2(用于雕刻铜线路版)
2FeCl3+Zn=2FeCl2+ZnCl2
FeCl3+Ag=FeCl2+AgCl
Fe2(SO4)3+2Ag=2FeSO4+Ag2SO4(较难反应)
Fe(NO3)3+Ag不反应
2FeCl3+H2S=2FeCl2+2HCl↑+S↓
2FeCl3+2KI=2FeCl2+2KCl+I2
FeCl2+Mg=Fe+MgCl2
TlCl3+2Ag=2AgCl+TlCl(铊、铅、铋的高价化合物都有强氧化性)
还原性
2FeCl2+Cl2=2FeCl3
SnCl2+Cl2=SnCl4(SnCl2有强还原性)
3Na2S+8HNO3(稀)=6NaNO3+2NO↑+3S↓+4H2O
3Na2SO3+2HNO3(稀)=3Na2SO4+2NO↑+H2O
2Na2SO3+O2=2Na2SO4
与碱性物质的作用
MgCl2+2NH3.H2O=Mg(OH)2↓+NH4Cl
AlCl3+3NH3.H2O=Al(OH)3↓+3NH4Cl
FeCl3+3NH3.H2O=Fe(OH)3↓+3NH4Cl
与酸性物质的作用:
Na3PO4+HCl=Na2HPO4+NaCl
Na2HPO4+HCl=NaH2PO4+NaCl
NaH2PO4+HCl=H3PO4+NaCl
Na2CO3+HCl=NaHCO3+NaCl
NaHCO3+HCl=NaCl+H2O+CO2↑
3Na2CO3+2AlCl3+3H2O=2Al(OH)3↓+3CO2↑+6NaCl
3Na2CO3+2FeCl3+3H2O=2Fe(OH)3↓+3CO2↑+6NaCl
3NaHCO3+AlCl3=Al(OH)3↓+3CO2↑
3NaHCO3+FeCl3=Fe(OH)3↓+3CO2↑
3Na2S+Al2(SO4)3+6H2O=2Al(OH)3↓+3H2S↑
3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl
不稳定性:
Na2S2O3+H2SO4=Na2SO4+S+SO2↑+H2O
NH4HCO3=NH3+H2O+CO2↑
2KNO3=2KNO2+O2↑
Cu(NO3)2=CuO+3NO2+O2↑
2KMnO4=K2MnO4+MnO2+O2↑(用于实验室准备氧气)
2KClO3=2KCl+3O2↑
2NaHCO3=Na2CO3+H2O+CO2↑
Ca(HCO3)2=CaCO3+H2O+CO2↑
CaCO3=CaO+CO2↑
MgCO3=MgO+CO2↑
H2SO3=H2O+SO2↑
ThI4=高温=Th+2I2↑(部分金属的碘化物高温下不稳定,分解反应用于提纯金属)
2NH4ClO4=Δ=N2↑+2O2↑+Cl2↑+4H2O↑(高氯酸铵用作火箭助推物,分解产生的大量气体能推动火箭升空)
2ClO2=加热或震荡=Cl2+2O2(二氧化氯不稳定,会爆炸性分解)
2BaO2=△=2BaO+O2↑(过氧化钡能在700℃分解)氧化还原1、木炭还原氧化铜:2CuO+C高温2Cu+CO2↑
2、钠在空气中燃烧:2Na+O2△==Na2O2钠与氧气反应:4Na+O2=2Na2O
3、过氧化钠与二氧化碳:2Na2O2+ 2CO2= 2Na2CO3+ O2置换反应1、硫酸根的检验:BaCl2+Na2SO4=BaSO4↓+2NaCl
2、碳酸根的检验: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
3、碳酸钠与盐酸: Na2CO3+ 2HCl = 2NaCl + H2O + CO2↑
5、铁片与硫酸铜溶液: Fe + CuSO4= FeSO4+ Cu
6、氯化钙与碳酸钠溶液:CaCl2+ Na2CO3= CaCO3↓+ 2NaCl
8、过氧化钠与水:2Na2O2+ 2H2O = 4NaOH + O2↑
10、钠与水:2Na + 2H2O = 2NaOH + H2↑
11、铁与水蒸气:3Fe + 4H2O(g) = Fe3O4 + 4H2↑
12、铝与氢氧化钠溶液:2Al + 2NaOH + 2H2O = 2NaAlO2+ 3H2↑
13、氧化钙与水:CaO + H2O = Ca(OH)2
14、氧化铁与盐酸:Fe2O3+ 6HCl = 2FeCl3+ 3H2O
15、氧化铝与盐酸:Al2O3+ 6HCl = 2AlCl3+ 3H2O
16、氧化铝与氢氧化钠溶液:Al2O3+ 2NaOH = 2NaAlO2+ H2O
17、氯化铁与氢氧化钠溶液:FeCl3+ 3NaOH = Fe(OH)3↓+ 3NaCl
18、硫酸亚铁与氢氧化钠溶液:FeSO4+ 2NaOH = Fe(OH)2↓+ Na2SO4
19、氢氧化亚铁氧化成氢氧化铁:4Fe(OH)2+ 2H2O + O2= 4Fe(OH)3
20、氢氧化铁分解:2Fe(OH)3△ ===Fe2O3+ 3H2O↑
21、实验室制取氢氧化铝:Al2(SO4)3+ 6NH3.H2O = 2Al(OH)3↓ + 3(NH4)2SO4
22、氢氧化铝与盐酸:Al(OH)3+ 3HCl = AlCl3+ 3H2O
23、氢氧化铝与氢氧化钠溶液:Al(OH)3+ NaOH = NaAlO2+ 2H2O
24、氢氧化铝分解:2Al(OH)3△== Al2O3+ 3H2O
25、三氯化铁溶液与铁粉:2FeCl3+ Fe = 3FeCl2
26、氯化亚铁中通入氯气:2FeCl2+ Cl2= 2FeCl3
27、二氧化硅与氢氟酸:SiO2+ 4HF = SiF4+ 2H2O 硅单质与氢氟酸反应:Si + 4HF = SiF4+ 2H2↑
28、二氧化硅与氧化钙高温:SiO2 + CaO 高温== CaSiO3
29、二氧化硅与氢氧化钠溶液:SiO2+ 2NaOH = Na2SiO3+ H2O
30、硅酸钠溶液中通入二氧化碳:Na2SiO3+ CO2+ H2O = Na2CO3+ H2SiO3↓
31、硅酸钠与盐酸:Na2SiO3+ 2HCl = 2NaCl + H2SiO3↓
32、氯气与铁:2Fe + 3Cl2点燃 ==2FeCl3
33、氯气与铜:Cu + Cl2点燃== CuCl2
34、氯气与钠:2Na + Cl2点燃 ==2NaCl
35、氯气与水:Cl2+ H2O = HCl + HClO
36、次氯酸光照分解:2HClO 光照== 2HCl + O2↑
37、氯气与氢氧化钠溶液:Cl2+ 2NaOH = NaCl + NaClO + H2O
38、氯气与消石灰:2Cl2+ 2Ca(OH)2= CaCl2+ Ca(ClO)2+ 2H2O
39、盐酸与硝酸银溶液:HCl + AgNO3= AgCl↓ + HNO3
40、漂白粉长期置露在空气中:Ca(ClO)2+ H2O + CO2= CaCO3↓ + 2HClO
41、二氧化硫与水:SO2+ H2O ≈ H2SO3
42、氮气与氧气在放电下:N2+ O2放电== 2NO
43、一氧化氮与氧气:2NO + O2= 2NO2
44、二氧化氮与水:3NO2+ H2O = 2HNO3+ NO
45、二氧化硫与氧气在催化剂的作用下:2SO2+ O2催化剂== 2SO3
46、三氧化硫与水:SO3+ H2O = H2SO4
47、浓硫酸与铜:Cu + 2H2SO4(浓) △== CuSO4+ 2H2O + SO2↑
48、浓硫酸与木炭:C + 2H2SO4(浓) △ ==CO2↑+ 2SO2↑ + 2H2O
49、浓硝酸与铜:Cu + 4HNO3(浓) = Cu(NO3)2 + 2H2O + 2NO2↑
50、稀硝酸与铜:3Cu + 8HNO3(稀) △== 3Cu(NO3)2+ 4H2O + 2NO↑
51、氨水分解:NH3.H2O △== NH3↑ + H2O
52、氨气与氯化氢:NH3+ HCl = NH4Cl
53、氯化铵分解:NH4Cl △== NH3↑ + HCl↑
54、碳酸氢氨分解:NH4HCO3△== NH3↑ + H2O↑ + CO2↑
55、硝酸铵与氢氧化钠:NH4NO3+ NaOH △== NH3↑ + NaNO3+ H2O
56、氨气的实验室制取:2NH4Cl + Ca(OH)2△== CaCl2+ 2H2O + 2NH3↑
57、氯气与氢气:Cl2+ H2点燃== 2HCl
58、硫酸铵与氢氧化钠:(NH4)2SO4+ 2NaOH △== 2NH3↑ + Na2SO4+ 2H2O
59、SO2+ CaO = CaSO37初中化学编辑氧气(1)单质与氧气的反应:(化合反应)
1.镁在氧气中燃烧:2Mg + O2点燃 ==2MgO
2.铁在氧气中燃烧:3Fe + 2O2点燃== Fe3O4
3.铜在氧气中受热:2Cu + O2加热 ==2CuO
4.铝在氧气中燃烧:4Al + 3O2点燃 ==2Al2O3
5.氢气在氧气中燃烧:2H2+ O2点燃 ==2H2O
6.红磷在氧气中燃烧(研究空气组成的实验):4P + 5O2点燃== 2P2O5
7.硫在氧气中燃烧: S + O2点燃== SO2
8.碳在氧气中充分燃烧:C + O2点燃== CO2
9.碳在氧气中不充分燃烧:2C + O2点燃== 2CO
(2)氧气与化合物的反应:
10.一氧化碳在氧气中燃烧:2CO + O2点燃== 2CO2
11.甲烷在氧气中燃烧:CH4+ 2O2点燃 ==CO2+ 2H2O
12.酒精在氧气中燃烧:C2H5OH + 3O2点燃== 2CO2+ 3H2O
(3)氧气的来源:
13.拉瓦锡研究空气的成分实验 2HgO 加热== 2Hg+ O2↑
14.加热高锰酸钾:2KMnO4加热== K2MnO4+ MnO2+ 2O2↑(实验室制氧气原理1)
15.加热氯酸钾和二氧化锰混合物:2KClO3加热== MnO2 2KCl+3O2↑ (实验室制氧气原理2)
16.过氧化氢在二氧化锰作催化剂条件下分解反应: 2H2O2==MnO2== 2H2O+ O2↑(实验室制氧气原理3)
植物的光合作用:6CO2+6H2O 阳光/叶绿素== 6O2+C6H12O6自然界中的水17.水在直流电的作用下分解(研究水的组成实验):2H2O 通电 ==2H2↑+ O2↑
18.生石灰溶于水:CaO + H2O == Ca(OH)2
19.二氧化碳可溶于水: H2O + CO2==H2CO3质量守恒定律20.镁在空气中燃烧:2Mg + O2点燃 ==2MgO
21.铁和硫酸铜溶液反应:Fe + CuSO4=== FeSO4+ Cu
22.氢气还原氧化铜:H2+ CuO 加热== Cu + H2O
23.镁还原氧化铜:Mg + CuO 加热 ==Cu + MgO碳和碳的氧化物(1)碳的化学性质
24.碳在氧气中充分燃烧:C + O2点燃== CO2
25.木炭还原氧化铜:C+ 2CuO 高温== 2Cu + CO2↑
26.焦炭还原氧化铁:3C+ 2Fe2O3高温== 4Fe + 3CO2↑
(2)煤炉中发生的三个反应:(几个化合反应)
27.煤炉的底层:C + O2点燃== CO2
28.煤炉的中层:CO2+ C 高温== 2CO
29.煤炉的上部蓝色火焰的产生:2CO + O2点燃 ==2CO2
(3)二氧化碳的制法与性质:
30.大理石与稀盐酸反应(实验室制二氧化碳):
CaCO3+ 2HCl == CaCl2+ H2O + CO2↑
31.碳酸不稳定而分解:H2CO3== H2O + CO2↑
32.二氧化碳可溶于水: H2O + CO2== H2CO3
33.高温煅烧石灰石(工业制二氧化碳):CaCO3高温 ==CaO + CO2↑
34.石灰水与二氧化碳反应(鉴别二氧化碳):
Ca(OH)2+ CO2=== CaCO3↓+ H2O
(4)一氧化碳的性质:
35.一氧化碳还原氧化铜:CO+ CuO 加热 ==Cu + CO2
36.一氧化碳的可燃性:2CO + O2点燃== 2CO2
其它反应
1.氢气在空气中燃烧:2H2+ O2点燃== 2H2O还原方程归总1.氢气还原氧化铜:H2+CuO加热==Cu+H2O
2.镁还原氧化铜:Mg+CuO加热==Cu+MgO
3.木炭还原氧化铜:C+2CuO高温==2Cu+CO2↑
4.焦炭还原氧化铁:3C+2Fe2O3高温==4Fe+3CO2↑
5.一氧化碳还原氧化铜:CO+CuO加热==Cu+CO2金属(1)金属与氧气反应:
40.镁在空气中燃烧:2Mg + O2点燃== 2MgO
41.铁在氧气中燃烧:3Fe + 2O2点燃== Fe3O4
42.铜在空气中受热:2Cu + O2加热== 2CuO
43.铝在空气中形成氧化铝薄膜:4Al + 3O2== 2Al2O3
(2)金属单质 + 酸 →盐 + 氢气 (置换反应)
44.锌和稀硫酸Zn + H2SO4= ZnSO4+ H2↑
45.铁和稀硫酸Fe + H2SO4= FeSO4+ H2↑
46.镁和稀硫酸Mg + H2SO4= MgSO4+ H2↑
47.铝和稀硫酸2Al +3H2SO4= Al2(SO4)3+3H2↑
48.锌和稀盐酸Zn + 2HCl == ZnCl2+ H2↑
49.铁和稀盐酸Fe + 2HCl == FeCl2+ H2↑
50.镁和稀盐酸Mg+ 2HCl == MgCl2+ H2↑
51.铝和稀盐酸2Al + 6HCl == 2Al(Cl2)3+ 3H2↑
(3)金属单质 + 盐(溶液) →新金属 + 新盐
52.铁和硫酸铜溶液反应:Fe + CuSO4== FeSO4+ Cu
53.锌和硫酸铜溶液反应:Zn + CuSO4==ZnSO4+ Cu
54.铜和硝酸汞溶液反应:Cu + Hg(NO3)2== Cu(NO3)2+ Hg
55.铜和硝酸银反应:Cu + 2AgNO3= 2Ag + Cu(NO3)2
56.铝和硫酸铜溶液反应:2Al +3CuSO4= Al2(SO4)3+3Cu
金属铁的冶炼原理
57.3CO+ 2Fe2O3高温 ==4Fe + 3CO2酸碱盐1、酸的化学性质
(1)酸 +金属→ 盐 + 氢气(见上)
(2)酸 +金属氧化物→ 盐 + 水
58.氧化铁和稀盐酸反应:Fe2O3+ 6HCl ==2FeCl3+ 3H2O
59.氧化铁和稀硫酸反应:Fe2O3+ 3H2SO4== Fe2(SO4)3+ 3H2O
60.氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2+ H2O
61.氧化铜和稀硫酸反应:CuO + H2SO4== CuSO4+ H2O
(3)酸 + 碱 → 盐 + 水(中和反应)
62.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O
63.盐酸和氢氧化钙反应:2HCl + Ca(OH)2== CaCl2+ 2H2O
64.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3== AlCl3+ 3H2O
65.硫酸和烧碱反应:H2SO4+ 2NaOH == Na2SO4+ 2H2O
(4)酸 + 盐 → 另一种酸 + 另一种盐
66.大理石与稀盐酸反应:CaCO3+ 2HCl == CaCl2+ H2O + CO2↑
67.碳酸钠与稀盐酸反应: Na2CO3+ 2HCl == 2NaCl + H2O + CO2↑
68.碳酸氢钠与稀盐酸反应:NaHCO3+ HCl== NaCl + H2O + CO2↑
69.硫酸和氯化钡溶液反应:H2SO4+ BaCl2== BaSO4↓+ 2HCl
碱的化学性质
(1)碱+非金属氧化物→盐+水
70.苛性钠暴露在空气中变质:2NaOH + CO2== Na2CO3+ H2O
71.苛性钠吸收二氧化硫气体:2NaOH + SO2== Na2SO3+ H2O
72.苛性钠吸收三氧化硫气体:2NaOH + SO3== Na2SO4+ H2O
73.消石灰放在空气中变质:Ca(OH)2+ CO2== CaCO3↓+ H2O
74.消石灰吸收二氧化硫:Ca(OH)2+ SO2== CaSO3↓+ H2O
(2)碱 + 酸 → 盐 + 水(中和反应,方程式见上)
(3)碱 + 盐 → 另一种碱 + 另一种盐
75.氢氧化钙与碳酸钠:Ca(OH)2+ Na2CO3== CaCO3↓+ 2NaOH
盐的化学性质
(1)盐(溶液) + 金属单质 → 另一种金属 + 另一种盐
76.铁和硫酸铜溶液反应:Fe + CuSO4== FeSO4+ Cu
(2)盐 + 酸 → 另一种酸 + 另一种盐
77.碳酸钠与稀盐酸反应: Na2CO3+ 2HCl == 2NaCl + H2O + CO2↑
碳酸氢钠与稀盐酸反应:NaHCO3+ HCl== NaCl + H2O + CO2↑
(3)盐 + 碱 → 另一种碱 + 另一种盐
78.氢氧化钙与碳酸钠:Ca(OH)2+ Na2CO3== CaCO3↓+ 2NaOH
(4)盐 + 盐 → 两种新盐
79.氯化钠溶液和硝酸银溶液:NaCl + AgNO3== AgCl↓ + NaNO3
80.硫酸钠和氯化钡:Na2SO4+ BaCl2== BaSO4↓ + 2NaCl
非金属单质
(F2,Cl2,O2,S,N2,P,C,Si,H)
氧化性
F2+H2===2HF (阴暗处爆炸)
F2+Xe(过量)==XeF2
2F2(过量)+Xe==XeF4(XeF4是强氧化剂,能将Mn2+氧化为MnO4–) nF2+2M===2MFn(M表示大部分金属)
2F2+2H2O===4HF+O2(水是还原剂)
Cl2+H2===2HCl (将H2在Cl2点燃;混合点燃、加热、光照发生爆炸)
Cl2+2NaBr===2NaCl+Br2 Cl2+2Br=2Cl+Br2
3Cl2(过量)+2KI+3H2O=6HCl+KIO3
Cl2+H2S=2HCl+S↓ (水溶液中:Cl2+H2S=2H++2Cl–+S↓
Cl2+H2O2=2HCl+O2 Cl2+H2O2=2H++Cl–+O2
2O2+3Fe=Fe3O4 O2+K=KO2
S+H2=H2S 2S+C=CS2 S+Zn=ZnS
S+Fe=FeS (既能由单质制取,又能由离子制取)
S+2Cu=Cu2S (只能由单质制取,不能由离子制取)
3S+2Al=Al2S3(只能由单质制取,不能由离子制取)
还原性
S+O2==SO2 S+H2SO4(浓) ===3SO2↑+2H2O
S+6HNO3(浓)===H2SO4+6NO2↑+2H2O
3S+4HNO3(稀)===3SO2+4NO↑+2H2O
3S+4H++4NO3-==SO2+4NO↑+2H2O
C+2F2==CF4 C+2Cl2==CCl4
C+O2(足量)===CO2 2C+O2(少量)===2CO
C+CO2===2CO C+H2O===CO+H2(生成水煤气)
2C+SiO2===Si+2CO(制得粗硅)
Si(粗)+2Cl2===SiCl4 (SiCl4+2H2===Si(纯)+4HCl)
Si+2NaOH+H2O==Na2SiO3+2H2↑ (Si+2OH+H2O=+2H2↑)
歧化反应
Cl2+H2O==HCl+HClO(加碱或光照促进歧化: (Cl2+H2O=H++Cl–+HClO)
Cl2+2NaOH==NaCl+NaClO+H2O (Cl2+2OH–=Cl–+ClO–+H2O)
Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O (Cl2+2OH–=Cl–+ClO–+H2O)
3Cl2+6KOH(浓)=5KCl+KClO3+3H2O (3Cl2+6OH–=5Cl–+ClO3–+3H2O)
3S+6NaOH=2Na2S+Na2SO3+3H2O (3S+6OH–=2S2–+SO32–+3H2O)
4P+3KOH(浓)+3H2O==PH3↑+3KH2PO2(4P+3OH–+3H2O==PH3↑+3H2PO2–)
11P+15CuSO4+24H2O==5Cu3P+6H3PO4+15H2SO4
初中化学
氧气
(1)单质与氧气的反应:(化合反应)
1.镁在氧气中燃烧:2Mg + O2点燃 ==2MgO
2.铁在氧气中燃烧:3Fe + 2O2点燃== Fe3O4
3.铜在氧气中受热:2Cu + O2加热 ==2CuO
4.铝在氧气中燃烧:4Al + 3O2点燃 ==2Al2O3
5.氢气在氧气中燃烧:2H2+ O2点燃 ==2H2O
6.红磷在氧气中燃烧(研究空气组成的实验):4P + 5O2点燃== 2P2O5
7.硫在氧气中燃烧: S + O2点燃== SO2
8.碳在氧气中充分燃烧:C + O2点燃== CO2
9.碳在氧气中不充分燃烧:2C + O2点燃== 2CO
(2)氧气与化合物的反应:
10.一氧化碳在氧气中燃烧:2CO + O2点燃== 2CO2
11.甲烷在氧气中燃烧:CH4+ 2O2点燃 ==CO2+ 2H2O
12.酒精在氧气中燃烧:C2H5OH + 3O2点燃== 2CO2+ 3H2O
(3)氧气的来源:
13.拉瓦锡研究空气的成分实验 2HgO 加热== 2Hg+ O2↑
14.加热高锰酸钾:2KMnO4加热== K2MnO4+ MnO2+ 2O2↑(实验室制氧气原理1)
15.加热氯酸钾和二氧化锰混合物:2KClO3加热== MnO2 2KCl+3O2↑ (实验室制氧气原理2)
16.过氧化氢在二氧化锰作催化剂条件下分解反应: 2H2O2==MnO2== 2H2O+ O2↑(实验室制氧气原理3)
植物的光合作用:6CO2+6H2O 阳光/叶绿素== 6O2+C6H12O6
自然界中的水
17.水在直流电的作用下分解(研究水的组成实验):2H2O 通电 ==2H2↑+ O2↑
18.生石灰溶于水:CaO + H2O == Ca(OH)2
19.二氧化碳可溶于水: H2O + CO2==H2CO3
质量守恒定律
20.镁在空气中燃烧:2Mg + O2点燃 ==2MgO
21.铁和硫酸铜溶液反应:Fe + CuSO4=== FeSO4+ Cu
22.氢气还原氧化铜:H2+ CuO 加热== Cu + H2O
23.镁还原氧化铜:Mg + CuO 加热 ==Cu + MgO
碳和碳的氧化物
(1)碳的化学性质
24.碳在氧气中充分燃烧:C + O2点燃== CO2
25.木炭还原氧化铜:C+ 2CuO 高温== 2Cu + CO2↑
26.焦炭还原氧化铁:3C+ 2Fe2O3高温== 4Fe + 3CO2↑
(2)煤炉中发生的三个反应:(几个化合反应)
27.煤炉的底层:C + O2点燃== CO2
28.煤炉的中层:CO2+ C 高温== 2CO
29.煤炉的上部蓝色火焰的产生:2CO + O2点燃 ==2CO2
(3)二氧化碳的制法与性质:
30.大理石与稀盐酸反应(实验室制二氧化碳):
CaCO3+ 2HCl == CaCl2+ H2O + CO2↑
31.碳酸不稳定而分解:H2CO3== H2O + CO2↑
32.二氧化碳可溶于水: H2O + CO2== H2CO3
33.高温煅烧石灰石(工业制二氧化碳):CaCO3高温 ==CaO + CO2↑
34.石灰水与二氧化碳反应(鉴别二氧化碳):
Ca(OH)2+ CO2=== CaCO3↓+ H2O
(4)一氧化碳的性质:
35.一氧化碳还原氧化铜:CO+ CuO 加热 ==Cu + CO2
36.一氧化碳的可燃性:2CO + O2点燃== 2CO2
其它反应:
37.碳酸钠与稀盐酸反应(化学反应式灭火器的原理):
Na2CO3+ 2HCl == 2NaCl + H2O + CO2↑
燃料及其利用
38.甲烷在空气中燃烧:CH4+ 2O2点燃== CO2+ 2H2O
39.酒精在空气中燃烧:C2H5OH + 3O2点燃== 2CO2+ 3H2O
40.氢气在空气中燃烧:2H2+ O2点燃== 2H2O
还原方程归总
1.氢气还原氧化铜:H2+CuO加热==Cu+H2O
2.镁还原氧化铜:Mg+CuO加热==Cu+MgO
3.木炭还原氧化铜:C+2CuO高温==2Cu+CO2↑
4.焦炭还原氧化铁:3C+2Fe2O3高温==4Fe+3CO2↑
5.一氧化碳还原氧化铜:CO+CuO加热==Cu+CO2
金属
(1)金属与氧气反应:
40.镁在空气中燃烧:2Mg + O2点燃== 2MgO
41.铁在氧气中燃烧:3Fe + 2O2点燃== Fe3O4
42.铜在空气中受热:2Cu + O2加热== 2CuO
43.铝在空气中形成氧化铝薄膜:4Al + 3O2== 2Al2O3
(2)金属单质 + 酸 →盐 + 氢气 (置换反应)
44.锌和稀硫酸Zn + H2SO4= ZnSO4+ H2↑
45.铁和稀硫酸Fe + H2SO4= FeSO4+ H2↑
46.镁和稀硫酸Mg + H2SO4= MgSO4+ H2↑
47.铝和稀硫酸2Al +3H2SO4= Al2(SO4)3+3H2↑
48.锌和稀盐酸Zn + 2HCl == ZnCl2+ H2↑
49.铁和稀盐酸Fe + 2HCl == FeCl2+ H2↑
50.镁和稀盐酸Mg+ 2HCl == MgCl2+ H2↑
51.铝和稀盐酸2Al + 6HCl == 2Al(Cl2)3+ 3H2↑
(3)金属单质 + 盐(溶液) →新金属 + 新盐
52.铁和硫酸铜溶液反应:Fe + CuSO4== FeSO4+ Cu
53.锌和硫酸铜溶液反应:Zn + CuSO4==ZnSO4+ Cu
54.铜和硝酸汞溶液反应:Cu + Hg(NO3)2== Cu(NO3)2+ Hg
55.铜和硝酸银反应:Cu + 2AgNO3= 2Ag + Cu(NO3)2
56.铝和硫酸铜溶液反应:2Al +3CuSO4= Al2(SO4)3+3Cu
(4)金属铁的冶炼原理:
57.3CO+ 2Fe2O3高温 ==4Fe + 3CO2
酸碱盐
1、酸的化学性质
(1)酸 +金属→ 盐 + 氢气(见上)
(2)酸 +金属氧化物→ 盐 + 水
58.氧化铁和稀盐酸反应:Fe2O3+ 6HCl ==2FeCl3+ 3H2O
59.氧化铁和稀硫酸反应:Fe2O3+ 3H2SO4== Fe2(SO4)3+ 3H2O
60.氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2+ H2O
61.氧化铜和稀硫酸反应:CuO + H2SO4== CuSO4+ H2O
(3)酸 + 碱 → 盐 + 水(中和反应)
62.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O
63.盐酸和氢氧化钙反应:2HCl + Ca(OH)2== CaCl2+ 2H2O
64.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3== AlCl3+ 3H2O
65.硫酸和烧碱反应:H2SO4+ 2NaOH == Na2SO4+ 2H2O
(4)酸 + 盐 → 另一种酸 + 另一种盐
66.大理石与稀盐酸反应:CaCO3+ 2HCl == CaCl2+ H2O + CO2↑
67.碳酸钠与稀盐酸反应: Na2CO3+ 2HCl == 2NaCl + H2O + CO2↑
68.碳酸氢钠与稀盐酸反应:NaHCO3+ HCl== NaCl + H2O + CO2↑
69.硫酸和氯化钡溶液反应:H2SO4+ BaCl2== BaSO4↓+ 2HCl
2、碱的化学性质
(1) 碱 +非金属氧化物→ 盐 + 水
70.苛性钠暴露在空气中变质:2NaOH + CO2== Na2CO3+ H2O
71.苛性钠吸收二氧化硫气体:2NaOH + SO2== Na2SO3+ H2O
72.苛性钠吸收三氧化硫气体:2NaOH + SO3== Na2SO4+ H2O
73.消石灰放在空气中变质:Ca(OH)2+ CO2== CaCO3↓+ H2O
74. 消石灰吸收二氧化硫:Ca(OH)2+ SO2== CaSO3↓+ H2O
(2)碱 + 酸 → 盐 + 水(中和反应,方程式见上)
(3)碱 + 盐 → 另一种碱 + 另一种盐
75.氢氧化钙与碳酸钠:Ca(OH)2+ Na2CO3== CaCO3↓+ 2NaOH
3、盐的化学性质
(1)盐(溶液) + 金属单质 → 另一种金属 + 另一种盐
76.铁和硫酸铜溶液反应:Fe + CuSO4== FeSO4+ Cu
(2)盐 + 酸 → 另一种酸 + 另一种盐
77.碳酸钠与稀盐酸反应: Na2CO3+ 2HCl == 2NaCl + H2O + CO2↑
碳酸氢钠与稀盐酸反应:NaHCO3+ HCl== NaCl + H2O + CO2↑
(3)盐 + 碱 → 另一种碱 + 另一种盐
78.氢氧化钙与碳酸钠:Ca(OH)2+ Na2CO3== CaCO3↓+ 2NaOH
(4)盐 + 盐 → 两种新盐
79.氯化钠溶液和硝酸银溶液:NaCl + AgNO3== AgCl↓ + NaNO3
80.硫酸钠和氯化钡:Na2SO4+ BaCl2== BaSO4↓ + 2NaCl
一、非金属单质的化学性质(F2,Cl2,O2,S,N2,P,C,Si,H)
1、氧化性:
F2+H2===2HF(阴暗处爆炸)
F2+Xe(过量)==XeF2
2F2(过量)+Xe==XeF4(XeF4是强氧化剂,能将Mn2+氧化为MnO4–)
nF2+2M===2MFn(M表示大部分金属)
2F2+2H2O===4HF+O2(水是还原剂)
Cl2+H2===2HCl (将H2在Cl2点燃;混合点燃、加热、光照发生爆炸)
Cl2+2NaBr===2NaCl+Br2 Cl2+2Br=2Cl+Br2
3Cl2(过量)+2KI+3H2O=6HCl+KIO3
Cl2+H2S=2HCl+S↓ (水溶液中:Cl2+H2S=2H++2Cl–+S↓
Cl2+H2O2=2HCl+O2 Cl2+H2O2=2H++Cl–+O2
2O2+3Fe=Fe3O4 O2+K=KO2
S+H2=H2S 2S+C=CS2 S+Zn=ZnS
S+Fe=FeS (既能由单质制取,又能由离子制取)
S+2Cu=Cu2S (只能由单质制取,不能由离子制取)
3S+2Al=Al2S3(只能由单质制取,不能由离子制取)
2、还原性
S+O2==SO2 S+H2SO4(浓) ===3SO2↑+2H2O
S+6HNO3(浓)===H2SO4+6NO2↑+2H2O
3S+4HNO3(稀)===3SO2+4NO↑+2H2O
3S+4H++4NO3-==SO2+4NO↑+2H2O
C+2F2==CF4 C+2Cl2==CCl4
C+O2(足量)===CO2 2C+O2(少量)===2CO
C+CO2===2CO C+H2O===CO+H2(生成水煤气)
2C+SiO2===Si+2CO(制得粗硅)
Si(粗)+2Cl2===SiCl4 (SiCl4+2H2===Si(纯)+4HCl)
Si+2NaOH+H2O==Na2SiO3+2H2↑ (Si+2OH+H2O=+2H2↑)
3、歧化反应
Cl2+H2O==HCl+HClO(加碱或光照促进歧化: (Cl2+H2O=H++Cl–+HClO)
Cl2+2NaOH==NaCl+NaClO+H2O (Cl2+2OH–=Cl–+ClO–+H2O)
Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O (Cl2+2OH–=Cl–+ClO–+H2O)
3Cl2+6KOH(浓)=5KCl+KClO3+3H2O (3Cl2+6OH–=5Cl–+ClO3–+3H2O)
3S+6NaOH=2Na2S+Na2SO3+3H2O (3S+6OH–=2S2–+SO32–+3H2O)
4P+3KOH(浓)+3H2O==PH3↑+3KH2PO2(4P+3OH–+3H2O==PH3↑+3H2PO2–)
11P+15CuSO4+24H2O==5Cu3P+6H3PO4+15H2SO4
记忆方法
掌握化学方程式的书写要领
左写反应物,右边写生成,写对化学式,系数来配平,中间连等号,条件要注清,生成沉淀气,箭头来标明。
归类记忆
根据知识系列或反应类型或物质类别记忆,使零散的知识通过归纳成为有规律可循、以重点物质为中心的知识网络。
联系实验现象记忆
化学方程式枯燥难记,如何使化学用语的学习有声有色、兴趣盎然,可联系实验现象记忆。如硫在氧气中燃烧,记忆联想:燃硫入氧,燃烧变旺,火焰蓝紫,美丽漂亮,产生气体,可真够“呛”。磷在氧气中燃烧,记忆联想:红磷燃烧,可真热闹,浓烟滚滚,亮似“灯泡”。